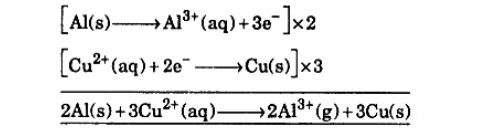واکنش های ردوکس بخش مهمی از شیمی است، زیرا شامل انتقال الکترون بین دو گونه است. واکنش های ردوکس مسئول فرآیندهای شیمیایی مختلفی مانند احتراق سوخت، زنگ زدگی فلزات و تولید الکتریسیته هستند. در این مقاله، ما اصول واکنشهای اکسیداسیون و کاهش، از جمله تعاریف اکسیداسیون و کاهش، نقش حالتهای اکسیداسیون، و انواع مختلف واکنشهای ردوکس را بررسی خواهیم کرد. همچنین در مورد کاربرد واکنش های ردوکس در زندگی روزمره بحث خواهیم کرد.
تعریف واکنش های ردوکس
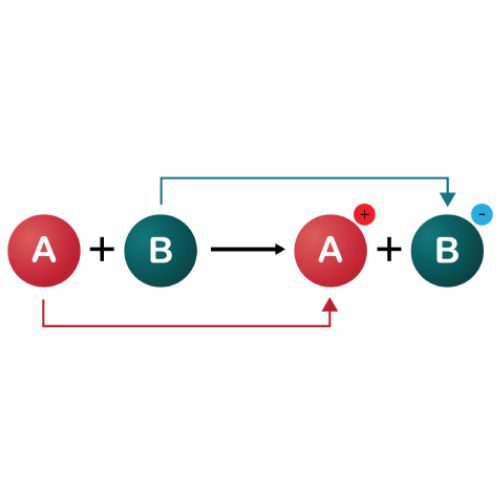
واکنشهای ردوکس که به عنوان واکنشهای اکسیداسیون – کاهش نیز شناخته میشوند، واکنشهای شیمیایی هستند که در آن حالتهای اکسیداسیون اتمها تغییر میکند. اکسیداسیون از دست دادن الکترون است، در حالی که کاهش، افزایش الکترون است. واکنشهای ردوکس شامل انتقال الکترونها بین دو گونه است و گونهای که الکترون از دست میدهد اکسیده میشود، در حالی که گفته میشود گونهای که الکترون به دست میآورد کاهش مییابد.
واکنش های ردوکس در بسیاری از زمینه های شیمی از جمله بیوشیمی، شیمی آلی و شیمی معدنی مهم هستند. واکنشهای ردوکس نیز در تولید انرژی سلولها مهم هستند، زیرا مسئول آزادسازی انرژی از مولکولهای غذا هستند.
نمونه هایی از واکنش های ردوکس
واکنشهای ردوکس که به عنوان واکنشهای اکسیداسیون – کاهش نیز شناخته میشوند، واکنشهای شیمیایی هستند که در آن حالتهای اکسیداسیون اتمها تغییر میکند. واکنش های ردوکس در بسیاری از زمینه های شیمی از جمله شیمی آلی، بیوشیمی و شیمی معدنی مهم هستند.
نمونه هایی از واکنش های ردوکس شامل سوزاندن سوخت های فسیلی، زنگ زدگی آهن و تنفس موجودات زنده است.
احتراق متان: احتراق متان (CH4) نمونه ای از واکنش ردوکس است. در این واکنش متان به دی اکسید کربن (CO2) و آب (H2O) اکسید می شود. اکسیداسیون متان با کاهش اکسیژن (O2) به آب همراه است. واکنش کلی را می توان به صورت زیر نوشت:
CH4 + 2O2 → CO2 + 2H2O 2
زنگ زدگی آهن: زنگ زدن آهن نمونه دیگری از واکنش ردوکس است. در این واکنش، آهن (Fe) به اکسید آهن (Fe2O3) اکسید می شود. اکسیداسیون آهن با کاهش اکسیژن (O2) به آب همراه است. واکنش کلی را می توان به صورت زیر نوشت:
4Fe + 3O2 → 2Fe2O3 + 4H2O
متعادل کردن واکنش های ردوکس
واکنشهای ردوکس یا واکنشهای اکسیداسیون – احیا، واکنشهای شیمیایی هستند که شامل انتقال الکترون بین دو گونه است. متعادل کردن واکنش های ردوکس بخش مهمی از شیمی است، زیرا به ما امکان می دهد محصولات یک واکنش و مقدار انرژی آزاد یا جذب شده را به طور دقیق پیش بینی کنیم.
اولین گام در ایجاد تعادل در واکنش ردوکس، شناسایی نیمه واکنش های اکسیداسیون و کاهش است. این شامل شناسایی گونه هایی است که اکسید و احیا می شوند و همچنین تعداد الکترون های منتقل شده. هنگامی که نیمه واکنش ها مشخص شد، باید از نظر اتم و بار متعادل شوند. این کار با افزودن ضرایب به واکنش دهنده ها و محصولات هر نیمه واکنش انجام می شود.
مرحله بعدی ترکیب دو نیمه واکنش است. این کار با جمع دو نیمه واکنش با هم و با در نظر گرفتن ضرایب هر گونه انجام می شود. این منجر به یک واکنش ردوکس متعادل می شود. در نهایت، واکنش باید بررسی شود تا از متعادل بودن آن از نظر اتم و بار اطمینان حاصل شود. اگر اینطور نیست، ضرایب باید تا زمانی که واکنش متعادل شود تنظیم شود. متعادل کردن واکنش های ردوکس بخش مهمی از شیمی است، زیرا به ما امکان می دهد محصولات یک واکنش و مقدار انرژی آزاد یا جذب شده را به طور دقیق پیش بینی کنیم. با تمرین، این مهارتی است که می توان به آن مسلط شد.
انواع واکنش های ردوکس
چهار نوع اصلی واکنش ردوکس وجود دارد: اکسیداسیون، کاهش، عدم تناسب و ترکیب.
اکسیداسیون از دست دادن الکترون از یک اتم یا مولکول است. این نوع واکنش اغلب با افزایش حالت اکسیداسیون همراه است. به عنوان مثال، اکسیداسیون آهن (Fe) به اکسید آهن (III) (Fe2O3) شامل از دست دادن دو الکترون از اتم آهن است.
کاهش، افزایش الکترون ها توسط یک اتم یا مولکول است. این نوع واکنش اغلب با کاهش در حالت اکسیداسیون همراه است. به عنوان مثال، احیای اکسید آهن (III) (Fe2O3) به آهن (Fe) شامل به دست آوردن دو الکترون توسط اتم آهن است.
عدم تناسب یک واکنش ردوکس است که در آن یک اتم یا مولکول هم اکسیده و هم احیا می شود. این نوع واکنش اغلب با تغییر در حالت اکسیداسیون همراه است. به عنوان مثال، عدم تناسب سولفید آهن (II) (FeS) به اکسید آهن (II) (FeO) و سولفید آهن (III) (Fe2S3) شامل اکسیداسیون سولفید آهن (II) به سولفید آهن (III) و احیا می شود. از سولفید آهن (III) به اکسید آهن (II).
ترکیب یک واکنش ردوکس است که در آن دو یا چند اتم یا مولکول با هم ترکیب شده و یک مولکول واحد را تشکیل می دهند. این نوع واکنش اغلب با تغییر در حالت اکسیداسیون همراه است. به عنوان مثال، ترکیب اکسید آهن (III) (Fe2O3) و هیدروژن (H2) برای تشکیل آب (H2O) شامل اکسیداسیون هیدروژن برای تشکیل آب و کاهش اکسید آهن (III) به آهن (Fe) است.
واکنشهای ردوکس برای بسیاری از زمینههای شیمی، از جمله شیمی آلی، بیوشیمی و شیمی معدنی ضروری هستند. آنها در تشکیل ترکیبات جدید، تجزیه ترکیبات موجود و انتقال الکترون ها بین اتم ها و مولکول ها مهم هستند.
اعداد اکسیداسیون
اعداد اکسیداسیون روشی برای پیگیری تعداد الکترون هایی است که یک اتم در یک واکنش شیمیایی به دست آورده یا از دست داده است. آنها برای کمک به شناسایی حالت اکسیداسیون یک اتم در یک مولکول یا یون استفاده می شوند.
اعداد اکسیداسیون بر اساس الکترونگاتیوی اتم ها و تعداد الکترون هایی که به دست آورده یا از دست داده اند به آنها اختصاص داده می شود. اعداد اکسیداسیون می توانند مثبت، منفی یا صفر باشند.
عدد اکسیداسیون مثبت نشان می دهد که اتم الکترون از دست داده است، در حالی که عدد اکسیداسیون منفی نشان می دهد که اتم الکترون به دست آورده است. عدد اکسیداسیون صفر نشان می دهد که اتم هیچ الکترونی به دست نیاورده یا از دست نداده است.
رایج ترین اعداد اکسیداسیون 1+، 2+، 3+ و 1-، 2-، 3- هستند. برای مثال، عدد اکسیداسیون اکسیژن در (H2O) -2 و عدد اکسیداسیون هیدروژن در (H2O) +1 است.
علاوه بر کمک به شناسایی حالت اکسیداسیون یک اتم، از اعداد اکسیداسیون نیز می توان برای تعیین نوع واکنشی که رخ داده است استفاده کرد. به عنوان مثال، اگر عدد اکسیداسیون یک اتم افزایش یابد، واکنش اکسیداسیون رخ داده است. به طور مشابه، اگر عدد اکسیداسیون یک اتم کاهش یابد، واکنش کاهشی رخ داده است.
اعداد اکسیداسیون یک مفهوم مهم در شیمی است و برای کمک به شناسایی حالت اکسیداسیون یک اتم در یک مولکول یا یون استفاده می شود. آنها همچنین می توانند برای تعیین نوع واکنش رخ داده استفاده شوند.
نیمه واکنش ها
نیمه واکنش ها نوعی واکنش شیمیایی هستند که شامل انتقال الکترون از یک گونه به گونه دیگر است. آنها برای توصیف واکنش های اکسیداسیون و کاهشی که در سلول های الکتروشیمیایی رخ می دهد استفاده می شوند. نیمه واکنش ها بر حسب واکنش دهنده ها و محصولات درگیر در واکنش و همچنین تعداد الکترون های منتقل شده نوشته می شوند.
آنها همچنین برای محاسبه پتانسیل استاندارد یک واکنش، که معیاری از انرژی آزاد یا جذب شده در طول واکنش است، استفاده می شوند. نیمه واکنش ها ابزار مهمی برای درک شیمی سلول های الکتروشیمیایی هستند و می توان از آنها برای پیش بینی جهت واکنش و میزان انرژی آزاد شده یا جذب شده استفاده کرد.
واکنش های ردوکس در سیستم های بیولوژیکی
واکنشهای ردوکس یا واکنشهای کاهش اکسیداسیون برای عملکرد سیستمهای بیولوژیکی ضروری هستند. این واکنش ها شامل انتقال الکترون بین مولکول ها و در نتیجه اکسید شدن یک مولکول و کاهش مولکول دیگر است.
واکنشهای ردوکس مسئول انواع فرآیندهای بیولوژیکی مهم از جمله تولید انرژی، متابولیسم و سیگنالدهی سلولی هستند. واکنشهای ردوکس در قلب تنفس سلولی قرار دارند، فرآیندی که طی آن سلولها انرژی غذا را به شکلی تبدیل میکنند که میتواند توسط سلول استفاده شود.
در طول تنفس، مولکولهای گلوکز اکسید میشوند و انرژی آزاد میکنند که برای تولید ATP، ارز انرژی سلول، استفاده میشود.
واکنشهای ردوکس نیز در فتوسنتز، فرآیندی که گیاهان انرژی نور را به انرژی شیمیایی تبدیل میکنند، نقش دارند.
واکنش های ردوکس نیز در متابولیسم ماکرومولکول ها مانند پروتئین ها و اسیدهای نوکلئیک نقش دارند. در طول متابولیسم پروتئین ها، اسیدهای آمینه اکسید می شوند و انرژی آزاد می شود که برای تشکیل پروتئین های جدید استفاده می شود.
در طی متابولیسم اسیدهای نوکلئیک، نوکلئوتیدها اکسید می شوند و انرژی آزاد می شود که برای تشکیل اسیدهای نوکلئیک جدید استفاده می شود.
واکنش های ردوکس نیز در سیگنال دهی سلولی نقش دارند. گونه های فعال اکسیژن، مانند پراکسید هیدروژن، در طی واکنش های ردوکس تولید می شوند و می توانند به عنوان مولکول های سیگنالی عمل کنند. این مولکولها میتوانند با پروتئینهای موجود در سلول تعامل داشته و واکنشهای سلولی مختلفی را تحریک کنند. واکنش های ردوکس برای عملکرد سیستم های بیولوژیکی ضروری است. این واکنش ها در تولید انرژی، متابولیسم و سیگنال دهی سلولی نقش دارند و برای بقای همه موجودات زنده ضروری هستند.
کاربرد واکنش های ردوکس
واکنش های ردوکس واکنش های شیمیایی هستند که در آن حالت اکسیداسیون یک یا چند اتم تغییر می کند. این واکنش ها در بسیاری از زمینه های مختلف، از بیوشیمی گرفته تا شیمی صنعتی، مهم هستند. واکنش های ردوکس در کاربردهای مختلفی از جمله تولید انرژی، جلوگیری از خوردگی، تصفیه آب و ساخت استفاده می شود.
تولید انرژی: از واکنش های ردوکس در سلول های سوختی استفاده می شود که دستگاه هایی هستند که انرژی شیمیایی را به انرژی الکتریکی تبدیل می کنند. سلول های سوختی از واکنش ردوکس برای ترکیب هیدروژن و اکسیژن برای تولید برق، گرما و آب استفاده می کنند. این فرآیند بسیار کارآمدتر از سوزاندن سوخت های فسیلی است و یک فناوری کلیدی در توسعه منابع انرژی تجدیدپذیر است.
جلوگیری از خوردگی: واکنش های ردوکس برای جلوگیری از خوردگی در فلزات استفاده می شود. با وارد کردن یک ماده واکنش پذیر به محیط، اکسیداسیون فلز را می توان کند یا متوقف کرد. این اغلب با استفاده از یک آند قربانی انجام می شود، که ماده ای است که راحت تر از فلزی که از آن محافظت می کند اکسید می شود.
تصفیه آب: واکنش های ردوکس برای حذف آلاینده ها از آب استفاده می شود. با وارد کردن یک عامل اکسید کننده مانند کلر به آب، می توان آلاینده ها را تجزیه و حذف کرد. این فرآیند در بسیاری از تصفیه خانه های آب برای اطمینان از سالم بودن آب برای آشامیدن استفاده می شود.
ساخت: واکنش های ردوکس در بسیاری از فرآیندهای صنعتی مانند تولید کودها، داروها و رنگ ها استفاده می شود. این واکنش ها همچنین برای تولید فلزاتی مانند آهن و آلومینیوم از سنگ معدن آنها استفاده می شود. واکنش های ردوکس بخش مهمی از بسیاری از فرآیندها و کاربردهای مختلف است. با درک نحوه عملکرد این واکنش ها، دانشمندان و مهندسان می توانند راه های جدید و بهبود یافته ای را برای استفاده از آنها در زمینه های مختلف ایجاد کنند.
واکنش های ردوکس برگشت پذیر
یک واکنش ردوکس برگشت پذیر یک واکنش شیمیایی است که در آن اکسیداسیون و احیا به طور همزمان اتفاق می افتد و در نتیجه واکنش دهنده ها و محصولات مشابهی ایجاد می شود. این نوع واکنش در زمینه الکتروشیمی مهم است، زیرا امکان انتقال الکترون بین دو گونه را فراهم می کند.
واکنش های ردوکس در کاربردهای مختلفی مانند تولید انرژی، تولید مواد شیمیایی و تصفیه فاضلاب استفاده می شود.
واکنش های ردوکس شامل انتقال الکترون بین دو گونه است که معمولاً یک عامل اکسید کننده و یک عامل احیا کننده است. عامل اکسید کننده گونه ای است که اکسید می شود یا الکترون از دست می دهد، در حالی که عامل احیا کننده گونه ای است که کاهش می یابد یا الکترون به دست می آورد.
اگر عامل اکسید کننده را بتوان کاهش داد و عامل احیا کننده را اکسید کرد، گفته می شود که واکنش برگشت پذیر است. واکنشهای ردوکس در زمینه الکتروشیمی مهم هستند، زیرا امکان انتقال الکترون بین دو گونه را فراهم میکنند. این نوع واکنش در تولید انرژی مانند باتری ها و پیل های سوختی استفاده می شود. همچنین در ساخت مواد شیمیایی مانند تولید پراکسید هیدروژن و کلر استفاده می شود.
در نهایت، واکنش های ردوکس در تصفیه فاضلاب استفاده می شود، زیرا امکان حذف آلاینده ها از آب را فراهم می کند. به طور خلاصه، یک واکنش ردوکس برگشت پذیر یک واکنش شیمیایی است که در آن اکسیداسیون و کاهش به طور همزمان اتفاق میافتد و در نتیجه واکنشدهندهها و محصولات مشابهی ایجاد میشود. این نوع واکنش در زمینه الکتروشیمی مهم است، زیرا امکان انتقال الکترون بین دو گونه را فراهم می کند.
تعادل در واکنش های ردوکس
واکنشهای ردوکس واکنشهای شیمیایی هستند که در آن حالت اکسیداسیون یک اتم، یون یا مولکول تغییر میکند. این واکنش ها شامل انتقال الکترون ها بین دو گونه است که منجر به تغییر در حالت اکسیداسیون یک یا هر دو گونه می شود.
تعادل در واکنش های ردوکس نقطه ای است که در آن غلظت واکنش دهنده ها و محصولات در طول زمان ثابت می ماند. در حالت تعادل، واکنش های رو به جلو و معکوس با سرعت یکسانی رخ می دهند، بنابراین غلظت واکنش دهنده ها و محصولات ثابت می ماند.
ثابت تعادل (K) اندازه گیری موقعیت تعادل در یک واکنش ردوکس است. به عنوان نسبت غلظت محصولات به غلظت واکنش دهنده ها در حالت تعادل تعریف می شود.
ثابت تعادل تحت تأثیر ماهیت واکنش دهنده ها و محصولات، دما و فشار است. به طور کلی، هر چه دما بالاتر باشد، ثابت تعادل بالاتر است.
فشار نیز بر ثابت تعادل تأثیر می گذارد، اما تأثیر آن معمولاً کم است. به منظور تغییر تعادل یک واکنش ردوکس، یا واکنش دهنده ها یا محصولات باید اضافه یا حذف شوند. اگر واکنش دهنده ها اضافه شوند، تعادل به سمت راست تغییر می کند و واکنش در جهت جلو ادامه می یابد. اگر محصولات حذف شوند، تعادل به سمت چپ تغییر می کند و واکنش در جهت معکوس ادامه می یابد. علاوه بر تغییر تعادل، افزودن یا حذف واکنش دهنده ها یا محصولات نیز می تواند بر سرعت واکنش تأثیر بگذارد. به عنوان مثال، اگر واکنش دهنده ها اضافه شوند، سرعت واکنش افزایش می یابد و اگر محصولات حذف شوند، سرعت واکنش کاهش می یابد.