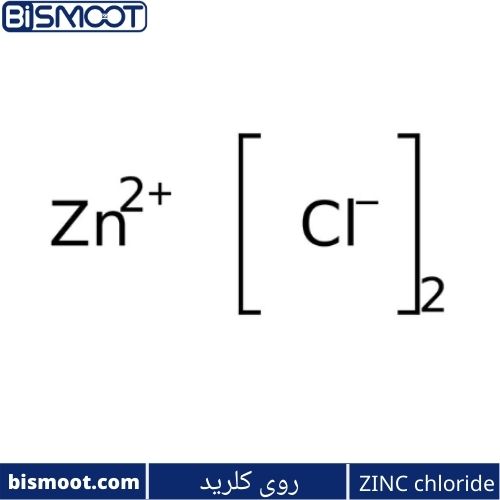
روی کلرید نام ترکیب شیمیایی با فرمول ZnCl2 و هیدراتهای آن است. روی کلرید، که به شکل کریستالی شناخته شده است، بی رنگ و یا سفید و در آب بسیار محلول هستند. بنابراین نمونه ها باید از منبع رطوبت، از جمله بخار آب موجود در هوای محیط محافظت شوند.
روی کلرید کاربرد گسترده ای در نساجی ، شارهای متالورژی و سنتز شیمیایی دارد. هیچ ماده معدنی با این ترکیب شیمیایی جدا از سیمونکلیلیت معدنی بسیار نادر ، Zn5 (OH) 8Cl2 · H2O شناخته نشده است.
کلرید روی دارای خصوصیات ریزسنجی است ، یعنی مولکول های آب موجود در محیط خود را جذب می کند.
خرید روی کلرید
شما میتوانید برای خرید روی کلرید با ما تماس گرفته و استعلام قیمت روز را داشته باشید یا میتوانید از طریق لینک زیر ثبت سفارش کرده و منتظر تماس همکاران ما برای اعلام قیمت و کسب اطلاعات بیشتر باشید.
شماره تماس ما : 021-28422797
ساختار روی کلرید
چهار شکل کریستالی (پلی مورف) از ZnCl2 شناخته شده است: α ، β ، γ و δ ، و در هر حالت یون های Zn2 به صورت چهار ضلعی با چهار یون کلرید هماهنگ می شوند.
در عکس بالا α, β, γ, ثابت های مشبک هستند و δ تعداد واحدهای ساختار در هر واحد و همینطورρ چگالی است که از پارامترهای ساختار محاسبه می شود.
شکل ارتورمبیکی خالص بدون آب (δ) به سرعت در معرض جو به یکی از اشکال دیگر تغییر می کند و یون های OH2 که از آب جذب می شوند، بازآرایی را تسهیل می کنند.
کلرید روی یک نمک باینری معدنی است. یک مولکول روی کلرید دارای پیوند یونی بین کاتیون روی (Zn2) و آنیونهای کلرید (Cl-) است. توجه به این نکته ضروری است که پیوند روی و کلر موجود در ZnCl2 دارای برخی خصوصیات کووالانسی است که نقطه ذوب کم آن و حلالیت آن در حلال های اتری است.
تاریخچه
سلول روی کلرید بدون کلرید آمونیوم در سال 1899 ثبت اختراع شد، اما عدم وجود دی اکسید منگنز بسیار فعال و ساخت سلولی با جداکننده های نازک و مهر و موم های کافی مانع از توسعه تجاری در مقیاس بزرگ شد.
در دهه 1950 و 1960 علاقه اول توسط R. Huber در آلمان غربی و بعد از آن توسط تولید کنندگان ژاپنی و ایالات متحده آمریکا احیا شد.
با داشتن دی اکسیدهای منگنز طبیعی یا فعال تر، جداکننده های کاغذ نازک که با پلیمرهای پایدار پوشانده شده اند ، و مهر و موم های پلاستیکی قالب ریزی شده یا سازه های مخصوص بستن ، چگالی توان بالاتر سیستم باعث شده است تا برای استفاده های سنگین از محبوبیت خاصی برخوردار شود.
ترکیبی از چگالی انرژی خوب و هزینه نسبی پایین منبع قدرت جالبی را فراهم می کند.
خصوصیات روی کلرید
خصوصیات کووالانسی ماده، بدون آب توسط نقطه ذوب نسبتاً کم آن 275 درجه سانتیگراد نشان داده شده است. شواهد بیشتر برای کووالانسیت با حلالیت زیاد دی کلرید در حلال های اتری وجود دارد، که ترکیب های افزایشی را با فرمول ZnCl2L2 تشکیل می دهد.
ذوب ZnCl2 دارای ویسکوزیته بالایی در نقطه ذوب آن و هدایت الکتریکی نسبتاً کم است که با درجه حرارت به میزان قابل توجهی افزایش می یابد.
هیدرات ها
پنج هیدرات شناخته شده خرید کلرید روی دارای فرمول کلی ZnCl2 (H2O) n هستند که در آن مقادیر n می تواند 1 ، 1.5 ، 2.5 ، 3 و 4 باشد. جامد ZnCl2 پلی مورفیسم را نشان می دهد و می تواند یکی از ساختارهای کریستالی زیر را بدست آورد: چهار ضلعی ، مونوکلینیک و ارتورمبیک!
تهیه و تصفیه کلرید روی
ZnCl2 بدون آب، می توان از کلرید و هیدروژن تهیه کرد:
Zn(s) + 2 HCl → ZnCl2 + H2(g)
فرم های هیدراته و محلول های آبی ممکن است به آسانی روی فلز روی با اسید هیدروکلریک تولید شود. اکسید روی و سولفید روی با HCl واکنش نشان می دهند:
ZnS(s) + 2 HCl(aq) → ZnCl2(aq) + H2S(g)
برخلاف بسیاری از عناصر دیگر، روی در اصل تنها در یک حالت اکسیداسیون ، 2+ وجود دارد ، که این امر تصفیه کلرید را ساده می کند. نمونه های تجاری روی کلرید معمولاً حاوی آب و محصولات حاصل از هیدرولیز به عنوان ناخالصی ها هستند.
چنین نمونه هایی ممکن است با تبلور مجدد از دی اکسان داغ خالص شوند. نمونه های بدون آب را می توان با تصعید در یک جریان از گاز کلرید هیدروژن ، خالص کرد و به دنبال آن گرم شدن سطح عالی به 400 درجه سانتیگراد در یک جریان از گاز نیتروژن خشک تولید کرد.
واکنش شیمیایی کلرید روی
در ترکیبات شیمیایی، روی تقریباً به طور انحصاری حالت اکسیداسیون +2 را نشان می دهد. چند ترکیب روی در حالت 1+ نیز دیده شده است، اما هرگز هیچ گونه ترکیبات روی در حالت +3 یا بالاتر نیست.
اکسید روی ، ZnO ، یکی از مهمترین ترکیبات روی است که می توان آن را در حالت خلوص بالا و در انواع اشکال و اندازه های کریستالی با سوزاندن بخار روی، در هوا تهیه کرد. اکسید روی به دلیل هدایت گرما و ظرفیت بالای گرما، غالباً به عنوان یک توزیع کننده گرما قرار می گیرد.
در بلور این ماده مشبک (یعنی ساختار منظمی که توسط یونها تشکیل می شود) یک باز است که در آن یونهای روی و اکسیژن تنها 44 درصد از حجم را اشغال می کنند.
تاثیرات مثبت روی کلرید
چنین کریستالی های خرید کلرید روی باعث ایجاد خواص الکتریکی ، فوتوالکتریک و کاتالیزوری مختلفی می شود. در نتیجه این ماده به عنوان نیمه هادی در تولید فسفور لوله های تلویزیونی و لامپ های فلورسنت استفاده می شود.
تأثیرات آن بر واکنش پذیری بسیاری از ترکیبات باعث می شود که در کارهایی مانند ساخت لاستیک مصنوعی و متانول به عنوان یک کاتالیزور، مفید واقع شود. همچنین در رنگ ها، محصولات آرایشی ، پلاستیک ، داروسازی و جوهر چاپ استفاده می شود.
از آنجا که تحت تأثیر نور می توان هدایت الکتریکی خرید روی کلرید را بارها افزایش داد و در فرآیندهای خاص فتوکپی از آن استفاده شود.
نحوه تولید روی کلرید
دو فرآیند اصلی برای تولید و خرید روی کلرید وجود دارد که در روش تولید مستقیم یا آمریکایی ، سنگ معدن روی (یا مواد باقیمانده) در هوا با کک یا آنتراسیت گرم می شوند و بخار روی حاصل در معرض اکسیداسیون کنترل شده قرار می گیرد.
در فرایند غیرمستقیم یا فرانسوی، بخار روی که باید اکسیده شود با جوشاندن روی بدست می آید.
روش های تولید
بسته به مواد اولیه، انواع مختلفی از روی کلرید وجود دارد که کاربردهای متفاوتی دارند. استفاده عمده به عنوان شتاب دهنده در جریان ساخت لاستیک اتومبیل ها است(لاستیک های اتومبیل حاوی 5 درصد خرید روی کلرید هستند).
همچنین این ماده در رنگها استفاده می شود، همینطور دارای خاصیت نیمه هادی می باشد، این خاصیت خاص حساسیت به نور یا نور رسانایی است که در فرآیندهای فتوکپی استفاده شده است. مصارف مختلف دیگر شامل ترکیب برای ساخت سرامیک ، مینای دندان و روان کننده ها است.
کاربرد های روی کلرید
خرید کلرید روی چینی در طیف گسترده ای از کاربردهای نسبتاً کوچک استفاده می شود. اولی در کشاورزی به عنوان از بین برنده علف های هرز و محافظت در برابر آفات استفاده می شود.
همچنین یکی از ترکیبات مهم رسوب کننده در ساخت ریون ویسکوز است. خرید روی کلرید چینی کاربردهای زیادی در صنعت نساجی و به عنوان ماده تشکیل دهنده در لحیم کاری ، پالایش آلومینیوم و گالوانیزه دارد.
کرومات های روی به عنوان مهار کننده های خوردگی و همچنین به عنوان رنگدانه های زرد روشن استفاده می شوند. فسفات روی علاوه بر اینکه از خوردگی در برابر آهن و فولاد محافظت می کند ، به صورت رنگ به عنوان یک رنگدانه ارگانیک وجود دارد و از این رو به عنوان ماده ضد خوردگی روی فولاد استفاده می شود.
استفاده در پزشکی
خرید روی کلرید صنعتی درجه دارویی یک اکسید با خلوص بالا است که توسط فرایند غیر مستقیم فرانسوی از فلز روی با خلوص بالا تولید می شود. از این ماده در تهیه پمادها، لوسیون ها و مواد آرایشی استفاده می شود.
کربنات روی یک ماده مغذی ملایم برای پوست است و به عنوان یک ماده لوسیون کالامین برای کاهش سوزش های پوستی استفاده می شود.
مشخصات فیزیکی
- کلرید روی مایع در دمای اتاق جامد است و ظاهری بلورین سفید دارد. بی بو است.
- حلالیت این ترکیب در آب با 432g / 100g مطابقت دارد. همچنین در استون ، اتانول و گلیسرول محلول است.
- خرید کلرید روی صنعتی مذاب بسیار چسبناک است و از ارزش هدایت الکتریکی نسبتاً کم برخوردار است.
خواص شیمیایی
- هنگامی که ZnCl2 در آب حل می شود ، محلول حاصل اسیدی است. pH محلول آبی خرید کلرید روی مایع با غلظت 6M 1 است.
- این ترکیب با آمونیاک واکنش نشان می دهد و شامل Zn (NH3) 4Cl2 و ZnCl2 (NH3) 2 می شوند.
- هنگام گرم شدن ، فرم هیدراته خرید روی کلرید چینی ، آب را از دست می دهد و مقادیر کمی از ZnCl (OH) به دست می آید.
موارد استفاده از روی کلرید چیست؟
از آنجا که با اکسیدهای فلزی واکنش نشان می دهد تا ترکیبات را با فرمول کلی MznOCl2 (جایی که M فلز است) انجام دهد، خرید کلرید روی مایع به عنوان یک عامل تمیز کننده برای لحیم کاری استفاده می شود که قابلیت حل لایه اکسیدها روی سطح فلز را دارند. برخی دیگر از کاربردهای این ترکیب در زیر آورده شده است.
- در حالت مذاب ، این ترکیب بعنوان یک کاتالیزور برای برخی از واکنش های معطر کننده عمل می کند. به عنوان مثال ، هگزامتیل بنزن را می توان با کمک یک ZnCl2 مذاب از متانول بدست آورد.
- از آنجا که به عنوان یک اسید لوئیس نسبتاً قوی عمل می کند، این ترکیب می تواند به عنوان یک کاتالیزور برای واکنش سنتز فیول ایندول فیبر و برخی واکنش های اتیلاسیون Friedel-Crafts عمل کند.
- مخلوطی از خرید روی کلرید صنعتی و هگزاکلروهتان در برخی نارنجک های دودزا استفاده می شود. پس از احتراق، این ترکیبات واکنش نشان می دهند و دود خرید روی کلرید مایع را تولید می کند.
- ZnCl2 در تشخیص اثر انگشت نیز مفید است زیرا یک ماده ای را که به راحتی قابل ردیابی است را تولید می کند.
- محلول های آبی این ترکیب در صورت رقیق شدن می توانند برای اهداف ضد عفونی کننده استفاده می شوند.
آیا کلرید روی برای مصرف بی خطر است؟
خرید روی کلرید صنعتی اگر خورده شود بسیار سمی است و در صورت استنشاق نیز یک ماده تحریک کننده قوی است. این ماده بسیار خورنده است و خوردن حتی 10 میلی لیتر از محلول 35٪ می تواند منجر به سوختگی دهان و معده ، حساسیت اپی گاستریک ، ورم حلق و خونریزی شود.
آیا کلرید روی یونی یا کووالانسی است؟
خرید کلرید روی چینی یک ترکیب یونی است. کاتیون موجود در این ترکیب روی و آنیون موجود در این ترکیب به صورت کلر است.
آماده سازی
واکنش بین فلز روی و گاز کلرید هیدروژن به فرم بدون آب کلرید منجر می شود. معادله شیمیایی برای این واکنش توسط:
روی + 2HCl → ZnCl2 + H2
به منظور به دست آوردن یک فرم هیدراته شده از اسید هیدروکلریک می توان به جای کلرید هیدروژن روی، برای تصفیه استفاده کرد. اسید هیدروکلریک نیز با سولفید روی واکنش می دهد تا این ماده و سولفید هیدروژن تشکیل شود. معادله شیمیایی برای این واکنش توسط:
ZnS + 2HCl → ZnCl2 + H2S
از آنجا که تنها حالت اکسیداسیون به نمایش گذاشته شده توسط روی +2 است ، تصفیه محصول نسبتاً ساده است.
ایمنی
این ماده به شدت سمی است. پس از تماس با پوست، فوری با استفاده از صابون و مقدار زیادی آب آن را بشویید. پس از تماس با چشم، با مقدار زیادی آب چشم را بشویید و با توجه به حساس بودن چشم پزشک در اسرع وقت به پزشک مراجعه کنید.
خرید کلرید روی صنعتی نسبت به دستگاه گوارش حساس است، علائم مسمومیت حاد شامل مشکل در دستگاه گوارش ، اسهال ، تهوع و درد شکمی است.
استفراغ تقریبا یکی از علائم همیشگی آن می باشد و دوز کشنده در انسان 3/5 گرم است. برای کاهش جذب فلز ممکن است پزشک برای بیمار شیر تجویز کند.
دیگر خصوصیات روی کلرید
ZnCl2 یک جامد یونی است ، اگرچه برخی از خصوصیات کووالانسی با نقطه ذوب کم آن (275 درجه سانتیگراد) نشان داده شده است. شواهد بیشتر برای کووالانسی توسط حلالیت بالای آن در حلال هایی مانند دی اتیل اتر ارائه شده است.
ZnCl2 یک اسید خفیف لوئیس است. مطابق با این ویژگی ، محلولهای آبی خرید روی کلرید چینی دارای pH برابر با 4 است. هنگامی که اشکال هیدراته گرم می شوند، به یک اکسی کلرید هیدرولیز تبدیل می شوند.
در محلول آبی ، خرید کلرید روی صنعتی منبع مفیدی از Zn2 برای تهیه سایر نمک های روی ، به عنوان مثال کربنات روی است:
ZnCl2( aq) + Na2CO3( aq) → ZnCO3( s) + 2 NaCl( aq)
منابع:
https://en.m.wikipedia.org/wiki/Zinc_chloride
https://byjus.com/chemistry/zinc-chloride-zncl2/
https://www.sciencedirect.com/topics/chemical-engineering/zinc-chloride