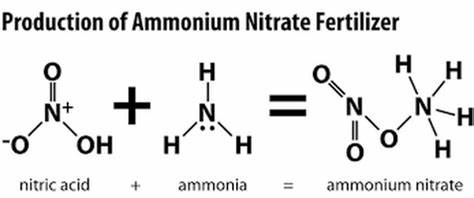
نیترات آمونیوم یک ترکیب شیمیایی با فرمول NH4 NO3 است و از ترکیب آمونیاک با اسید نیتریک ساخته می شود. نیترات آمونیوم نمکی کریستالی بدون بو ، بی رنگ یا سفید است. نیترات آمونیوم معمولاً به عنوان کود برای مصارف کشاورزی استفاده می شود – از آنجا که بسیار محلول است – اما به عنوان ماده منفجره صنعتی نیز استفاده می شود. یکی از محققان اعلام کرد که دلیل استفاده از آن به عنوان ماده منفجره این است که می تواند بسیار کارآمد باشد.از یک طرف ، آمونیوم دارای هیدروژن است. در طرف دیگر اکسیژن و نیتروژن وجود دارد. و بنابراین وقتی دو نیمه به نوعی مجبور شوند که با هم جمع شوند ، مقدار زیادی گاز و مقدار زیادی گرم شود .
پیشنهاد میشود در راستای استفاده از نیترات آمونیوم،متن پتاسیم نیترات سایت را مطالعه فرمایید.
خرید نیترات آمونیوم
برای خرید نیترات آمونیوم و استعلام قیمت میتوانید با ما تماس بگیرید یا در صورت تمایل ثبت سفارش کنید تا در اولین فرصت با شما تماس بگیریم.
شماره تماس سریع برای خرید نیترات آمونیوم :021-28422797
| شماره تماس برای خرید این محصول | 02128422797 |
| CAS NUMBER | 6484-52-2 |
| فرمول شیمیایی | NH₄NO₃ |
| گرید های موجود | گرید کشاورزی |
| نام انگلیسی | Ammonium nitrate |
| قابلیت ارسال(روش ارسال) | دارد(ارسال با باربری و ماشین مستقیم) |
| قیمت | تماس بگیرید |
| برگه آنالیز | تماس بگیرید |
| خلوص های موجود | 99 درصد |
| شکل ظاهری | گرانول |
| بسته بندی | کیسه های 50 کیلویی |
| کشور تولید کننده | ایران |
| امکان واردات اختصاصی | |
| حداقل میزان قابل سفارش | 1 کیسه |
| شماره تماس برای خرید های کمتر از حداقل میزان سفارش مشخص شده | 09941413630 |
| تضمین کیفیت | دارد |
| تضمین اصالت | دارد |
| تضمین مطابق بودن با آنالیز | دارد |
خواص فیزیکی
حالت فیزیکی آن جامد است و به طور معمول به صورت پودری سفید ، بلوری یا مهره ای وجود دارد. دمای ذوب آن 169.6 درجه سانتیگراد ، نقطه جوش 210 درجه سانتیگراد و چگالی 1.72 گرم بر سانتی متر مکعب است.
خواص شیمیایی
نیترات آمونیوم به راحتی در آب حل می شود. همچنین بسیار مرطوب کننده است ، به این معنی که به راحتی آب جو را جذب کرده و بهم می پیوندد. واکنش خاصی ندارد و نسبتاً پایدار است. در دمای بالا (بیش از 200 درجه سانتیگراد) تجزیه می شود و اکسید نیتروژن و بخار آب ایجاد می کند.
تشکیل نیترات آمونیوم
نیترات آمونیوم نمک نیترات کاتیون آمونیوم (که گاهی اوقات به صورت N2H4O3 نوشته می شود) که یک جامد بلوری سفید است و در آب بسیار محلول است. نیترات آمونیوم غالباً در کشاورزی به عنوان کودی با نیتروژن بالا مورد استفاده قرار می گیرد و همچنین به عنوان جزئی از مخلوط های منفجره در استخراج معادن ، معادن و ساخت و سازهای غیر نظامی مورد استفاده قرار می گیرد.
فرایند های تشکیل
این فرآیند شامل چندین عملیات فرآیند واحد شامل (1) تشکیل و غلظت محلول ، (2) تشکیل مواد جامد ، (3) اتمام ، (4) غربال و پوشش و (5) کیسه محصول و / یا حمل و نقل فله است. در بعضی موارد ، ممکن است محلول ها برای بازاریابی به عنوان کودهای مایع مخلوط شوند.
تعداد عملیات ها
تعداد مراحل عملیاتی به مشخصات محصول بستگی دارد. به عنوان مثال ، گیاهان تولید کننده محلول های نیترات آمونیوم به تنهایی فقط از ترکیبات محلول ، ترکیب محلول ها و حمل و نقل فله استفاده می کنند. گیاهان تولید کننده یک محصول جامد خرید نیترات آمونیوم صنعتی ممکن است همه عملیات را انجام دهند. تقریباً 15٪ –20٪ (v / v) خرید نیترات آمونیوم مایع تهیه شده به این روش برای مواد منفجره و تعادل برای کود استفاده می شود.
کاربرد های نیترات آمونیوم
برای تهیه کود و مواد منفجره و به عنوان ماده مغذی در تولید آنتی بیوتیک و مخمر استفاده می شود. خرید نیترات آمونیوم نمک آمونیوم اسید نیتریک است. نیترات آمونیوم به عنوان کود ، مواد منفجره و ماده اکسید کننده نقش دارد.
چگونگی عرضه به بازار
نیترات آمونیوم بسته به کاربرد آن به اشکال مختلف به بازار عرضه می شود و ماندگاری آن 6 ماه پس از تولید است . به عنوان مثال ، خرید نیترات آمونیوم مایع ممکن است به عنوان کود فروخته شود ، به طور کلی در ترکیب با اوره یا ممکن است خرید نیترات آمونیوم مایع غلیظ شود و به عنوان یک مذاب خرید نیترات آمونیوم برای استفاده در فرآیند های تشکیل مواد جامد تشکیل شود.
نیترات آمونیوم جامد
نیترات آمونیوم جامد ممکن است به صورت گلدان ، دانه ، گرانول یا کریستال تولید شود. کوره های نیترات آمونیوم بسته به غلظت مذاب به دو صورت چگالی بالا یا کم تولید می شوند. دانه ها ، گرانول ها و کریستال های با چگالی بالا به عنوان کود استفاده می شوند ، در حالی که دانه های نیترات آمونیوم فقط در مواد منفجره و پریل های(به محصولی گفته می شود که گلوله شده است) با چگالی کم که سنگدانه های کوچک یا گلوله های مواد هستند – اغلب یک کره خشک – از مایع ذوب شده تشکیل می شوند.
مزایای آن در کشاورزی
دلیل محبوبیت بسیار آن در کشاورزی به دلیل وجود مقدار زیاد نیتروژن در این ترکیب است. نیتروژن یک ماده مغذی بسیار مهم در گیاه است که به رشد و فرآیندهای متابولیکی گیاه کمک می کند. کشاورزان عاشق استفاده از خرید نیترات آمونیوم صنعتی هستند زیرا این یک گزینه ارزان برای کودهای گران قیمت است. همچنین می تواند رشد سریعی داشته باشد و ممکن است ظرفیت تولید میوه گیاه را افزایش دهد. همچنین ممکن است کیفیت سبزیجات برگ سبز را تحت تأثیر قرار دهد زیرا نیتروژن مورد استفاده گیاهان در روند فتوسنتز بسیار مفید است.
معایب استفاده از کودها
آنها به راحتی توسط آب شسته می شوند و باعث آلودگی می شوند.آنها به میکروب های موجود در خاک آسیب می رسانند.آنها حاصلخیزی خاک را کاهش می دهند.آنها گران هستند.آنها فقط مزایای کوتاه مدت را فراهم می کنند.آنها ماهیت خاک را تغییر می دهند و آن را بیش از حد اسیدی یا قلیایی می کنند.
تولید غبار و ذرات معلق
ذرات معلق، آمونیاک و اسید نیتریک در فرایند ساخت و خرید نیترات آمونیوم باعث تولید ذرات معلق ، آمونیاک و انتشار اسید نیتریک می شود. انتشار از آمونیاک و اسید نیتریک در درجه اول هنگامی که محلول تشکیل می دهند (خنثی کننده ها و غلیظ کننده ها) و هنگامی که در دانه بندی ها استفاده می شوند ، رخ می دهد. ذرات بزرگترین منبع هستند و در طول فرآیند تولید مواد جامد ساطع می شود.
برج های پریل در تولید ذرات معلق
برج های پریل و دانه بندی بزرگترین منبع ذرات معلق هستند. میکروپروایل ها می توانند روزنه ها را تشکیل داده و مسدود کنند ، باعث افزایش بارگیری گرد و غبار و انتشار می شوند.
عملیات غربالگری
انتشار در اثر غربالگری با اصابت مواد جامد نیترات آمونیوم صنعتی به یکدیگر و صفحه نمایش ها اتفاق می افتد. اکثر این عملیات غربالگری محصور شده یا دارای پوشش های جزئی برای کاهش انتشار هستند. پوشش محصولات همچنین ممکن است برخی از انتشارات ذرات را هنگام اختلاط در طبل های دوار ایجاد کند. این گرد و غبار معمولاً برای ذخیره سازی پوشش گرفته و بازیافت می شود.
آیا نیترات آمونیوم ماده منفجره است ؟
نیترات آمونیوم که در کودها و بمب سازی ها استفاده می شود ، نمکی است که از آمونیوم و اسید نیتریک ساخته می شود و بسیار منفجره است. هرچه نیترات آمونیوم مایع یا NH4-NO3 بیشتر باشد ، ظرفیت انفجاری آن نیز بیشتر است. … هنگامی که یک واکنش ایجاد شد ، خرید نیترات آمونیوم صنعتی به شدت منفجر می شود.
موارد استفاده از نیترات آمونیوم
برای تهیه کود و مواد منفجره و به عنوان ماده مغذی در تولید آنتی بیوتیک و مخمر استفاده می شود. خرید نیترات آمونیوم صنعتی نمک آمونیوم اسید نیتریک است. خرید نیترات آمونیوم مایع به عنوان کود ، مواد منفجره و ماده اکسید کننده نقش دارد.
افزودن نیترات آمونیوم به آب
این ماده از پیوندهای یونی تشکیل شده است که کاملاً در هم قرار گرفته اند. هنگامی که با آب تماس پیدا می کند ، مولکول های قطبی آب با آن یون ها تداخل می کنند و در نهایت باعث پراکنده شدن آنها می شوند. برای این کار انرژی لازم است ، که از محیط اطراف جذب شده و محلول را سرد می کند. در حالی که هنگام تعامل یونهای نیترات آمونیوم با مولکولهای آب مقداری گرما تولید می شود (یعنی یک واکنش گرمازا) ، بسیار کمتر از آنچه برای مولکولهای آب برای پراکنده شدن پیوندهای یونی قوی خرید نیترات آمونیوم صنعتی لازم است.
واکنش با آب
کل فرآیند یک واکنش گرماگیرانه است ، یا واکنشی است که انرژی را از محیط اطراف خود جذب می کند. به همین دلیل است که از جامد خرید نیترات آمونیوم در بسته های سرد تجاری استفاده می شود ، که در واقع فقط مخلوطی از خرید نیترات آمونیوم صنعتی و آب است.
آسیب دیدگی
می توانید محتوای کیسه را با هم مخلوط کرده و روی قسمت آسیب دیده بدن خود قرار دهید. واکنش گرماگیر مخلوط مایع نیترات آمونیوم و آب گرما را از بخشی از بدن برداشته و منطقه دردناک را “یخ می زند”.
نیترات آمونیوم یک نمک است؟
این ماده، (NH4NO3) ، نمکی از آمونیاک و اسید نیتریک ، که به طور گسترده ای در کودها و مواد منفجره استفاده می شود. درجه تجاری حاوی حدود 33.5 درصد ازت است که همگی به اشکال قابل استفاده توسط گیاهان اسیدی یا بازی خرید نیترات آمونیوم مایع اسید نیست بلکه نمک است اما محلول اسیدی است زیرا نمکی با پایه ضعیف (هیدروکسید آمونیوم) و اسید نیتریک سنگین است.
نیترات آمونیوم مایع
خرید مایع نیترات آمونیوم کریستالهای سفید محلول در آب است. اگرچه نیترات آمونیوم به خودی خود غیر قابل احتراق است ، اما سوختن مواد قابل احتراق را تسریع می کند. اکسیدهای سمی نیتروژن در آتش سوزی های خرید نیترات آمونیوم تولید می شود. برای تهیه کود و مواد منفجره استفاده می شود.
نیترات آمونیوم و تاثیر آن بر رشد گیاه
تاثیر بر phخاک افزایش غلظت پروتون در اطراف ریشه ، PH اطراف ریشه را کاهش می دهد. بر این اساس ، وقتی گیاه نیترات (NO3-) مصرف می کند ، بی کربنات (HCO3-) آزاد می کند که باعث افزایش pH اطراف ریشه می شود. می توان نتیجه گرفت که جذب نیترات باعث افزایش pH در اطراف ریشه می شود در حالی که جذب آمونیوم باعث کاهش آن می شود. در نتیجه : برای جلوگیری از تغییر سریع pH متوسط ، باید نسبت آمونیوم / نیترات متناسب با رقم ، دما و مرحله رشد را حفظ کنیم.
چگونگی استفاده از نیترات آمونیوم
این ماده یکی از اجزای مهم بسیاری از مخلوط های کودی است. این یک منبع نیتروژن برای گیاهان فراهم می کند ، که باعث افزایش رشد و عملکرد محصول می شود. مقادیر کم خرید نیترات آمونیوم نیز به عنوان افزودنی برای استخراج مواد منفجره و سایر مصارف غیرکشاورزی فروخته می شود.
خطرات
در شرایط معمول حمل و نقل ، نیترات آمونیوم مضر نیست. با این حال ، استنشاق غلظت زیاد غبار خرید نیترات آمونیوم صنعتی می تواند باعث تحریک دستگاه تنفسی شود. علائم ممکن است شامل: سرفه ، گلودرد ، تنگی نفس یا حتی خفگی باشد. در صورت بلعیدن در غلظت های بالا ، خرید نیترات آمونیوم مایع ممکن است باعث سردرد ، سرگیجه ، درد شکم ، استفراغ ، اسهال خونی ، ضعف ، احساس سوزن سوزن شدن ، بی نظمی قلب و گردش خون ، تشنج ، فروپاشی و خفگی شود.
اشتعال پذیری
درجه نیترات آمونیوم قابل اشتعال نیست ، آتش سوزی ناشی از خرید نیترات آمونیوم مایع بسیار بعید است ، اما یک ماده اکسید کننده قوی است که می تواند باعث شعله ور شدن مواد قابل احتراق (مانند چوب ، کاغذ و روغن) شود. در چه صورت منفجر میشود در شرایط شدید گرما و فشار در یک فضای محدود این ماده منفجر می شود. در صورت وقوع چنین حادثه ای ، ممکن است ابر قابل مشاهده ای از آمونیاک ، دی اکسید کربن و اکسیدهای نیتروژن وجود داشته باشد.
دمای انفجار
210 درجه سانتیگراد
خرید نیترات آمونیوم مایع در دمای بالاتر از 210 درجه سانتیگراد (410 درجه فارنهایت) تجزیه و منفجر می شود.
منابع قابل ارجاع برای مطالعه بیشتر : https://www.sciencedirect.com/topics/chemistry/ammonium-nitrate






5 دیدگاه دربارهٔ «خرید نیترات آمونیوم;
از شما برای راحتی یک پلت فرم آنلاین که به من اجازه داد به راحتی مواد شیمیایی عمده مورد نظر را جستجو و انتخاب کنم، سپاسگزارم.
ممنون از نظر شما
ما در مجموعه به صورت آنلاین بیش از 200 محصول را داریم و بیش از 300 محصول دیگر را نیز داریم که هنوز وقت نکرده ایم به صورت آنلاین اطلاعاتش را در اختیار عموم قرار بدهیم
سلام خسته نباشی.هر بسته ۵۰کیلویی جامد.قیمتش چقدر هست مهندس
فعلا تولید متوقفه
سولفات آمونیوم نیترات موجود داریم
برای اطلاع قیمت روز تماس بگیرید.
نیازمند نیترات امونیوم برای صادرات هستیم