پتاسیم هیدروکسید یک ترکیب معدنی با فرمول KOH است و معمولاً پتاس نامیده می شود.
هیدروکسید پتاسیم که به آن پتاس کاستیک نیز گفته می شود، یک ترکیب شیمیایی با فرمول KOH است. پتاسیم هیدروکسید خالص شده یک جامد سفید است که از نظر تجاری به صورت گلوله و پوسته در دسترس است. مشابه هیدروکسید سدیم (سود سوز آور، NaOH)، پتاسیم هیدروکسید، یک قلیایی قوی، بسیار محلول در آب و بسیار خورنده است. برای کاربردهای مختلفی از جمله تولید صابون، بیودیزل، باتری، پیل سوختی و کود مفید است.
خرید پتاسیم هیدروکسید
پتاسیم هیدروکسید یا همان پتاس در بازار برای خرید در مقادیر صنعتی و آزمایشگاهی با برند های مختلفی موجود است که شما میتوانید با تماس با ما (021-28422797) قیمت روز آن را برای خرید پتاس در هر مقداری جویا شده و قیمت مناسب و برند مناسب کار خود را داشته باشید
شماره تماس ما: 021-28422797
قیمت پتاسیم هیدروکسید
پتاسیم هیدروکسید با توجه به این که جنس وارداتی هست، قیمت آن با نوسانات ارز تغییر پیدا میکند. لطفا برای اطلاع از قیمت پتاسیم هیدروکسید با ما تماس بگیرید. (قیمت پتاسیم هیدروکسید ۱ کیلویی و قیمت پتاس تناژ متفاوت است. همچنین برای خرده فروشی با قسمت فروش آزمایشگاهی ما در تماس باشید.)
این نمک پتاسیم در بازار ایران دارای برند های مختلفی است که در زیر چند نمونه رایج آن را برای شما توضیح داده ایم.
فروش هیدروکسید پتاسیم چینی
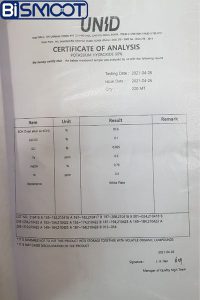
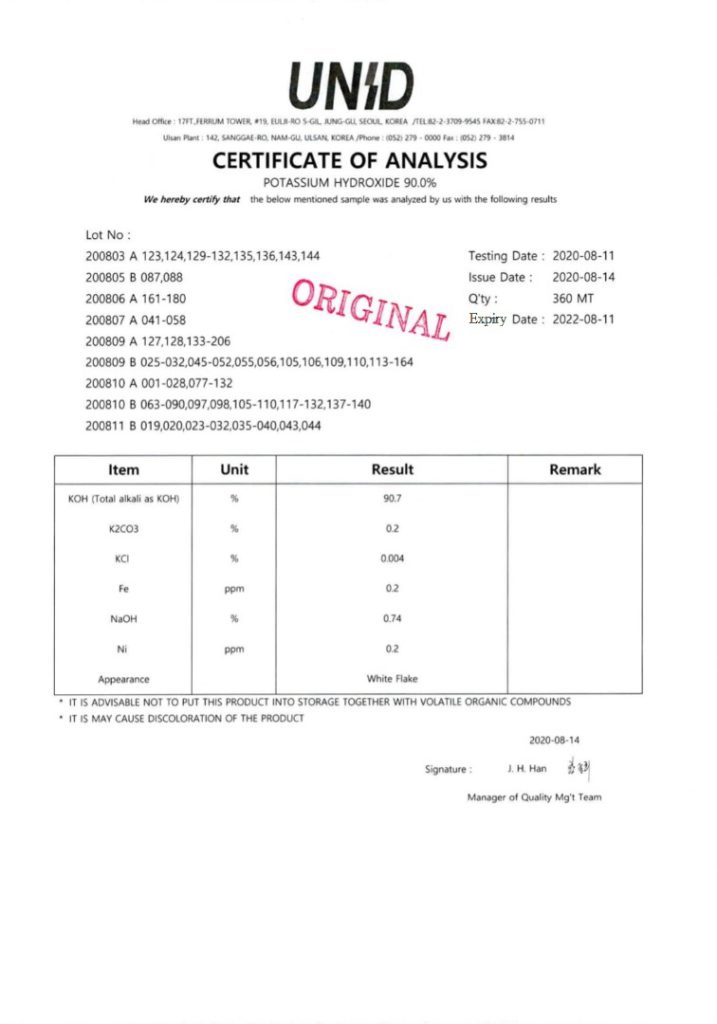
پتاسیم هیدروکسید چینی با آنالیز رو به رو یکی از پرفروش ترین پتاس های موجود است که دلیل آن قیمت پایین تر آن نسبت به دیگر پتاس های موجود در بازار است
فروش هیدروکسید پتاسیم کره ای
قیمت پتاسیم هیدروکسید در ایران بشدت با قیمت این پتاس در بازار سنجیده میشود چرا که کارخانه های مهم و داروسازی ها حتما از این پتاس با کیفیت استفاده میکنند.
فروش هیدروکسید پتاسیم مرک
این نوع از پتاسیم هیدروکسید برای استفاده در آزمایشگاه ها بیشتر استفاده میشود که برای این مورد با شماره ما تماس گرفته و با بخش آزمایشگاهی ما تماس بگیرید.
با توجه به قیمت پتاسیم هیدروکسید در ایران چگونه بهترین خرید را داشته باشیم؟
با توجه به فروش پتاسیم هیدروکسید در بازار فعلی ما پیشنهاد ویژه ای داریم که خرید پتاس روسیه است که کیفیت قابل قبولی برای اکثر صنایع را دارد و همچنین قیمت بشدت مناسب ترین نسبت به نمونه یونید کره را دارد. برای اطلاع از جزئیات بیشتر با تماس بگیرید.
خواص
| فرمول شیمیایی | KOH |
| جرم مولی | 56.11 گرم مول − 1 |
| ظاهر | سفید جامد |
| بو | بدون بو |
| تراکم | 2.044 گرم در سانتی متر مکعب (20 درجه سانتیگراد) |
| چگالی | 2.12 گرم در سانتی متر مکعب (25 درجه سانتیگراد) |
| نقطه ذوب | 360 درجه سانتیگراد (680 درجه فارنهایت ؛ 633 کیلوگرم) |
| نقطه جوش | 1،327 ° C (2421 ° F ؛ 1600 K) |
| حلالیت در آب | 121 گرم در 100 میلی لیتر (25 درجه سانتیگراد) |
| حلالیت در متانول | 55 گرم در 100 گرم (28 درجه سانتیگراد) |
| حلالیت در ایزوپروپانول | 14 گرم در 100 گرم (در 28 درجه سانتیگراد) |
| نقطه اشتعال | غیر قابل اشتعال |
روش تولید هیدروکسید پتاسیم
از لحاظ تاریخی، KOH با افزودن کربنات پتاسیم به محلول قوی هیدروکسید کلسیم (آهک ذوب شده) ساخته می شود. واکنش متاتز نمک منجر به رسوب کربنات کلسیم جامد می شود و پتاسیم هیدروکسید را در محلول باقی می گذارد:
Ca(OH)2 + K2CO3 → CaCO3 + 2KOH
با فیلتر کردن کربنات کلسیم رسوبی و جوشاندن محلول، هیدروکسید پتاسیم (“پتاس کلسینه یا سوزاننده”) بدست می آید. این روش تولید پتاسیم هیدروکسید تا اواخر قرن 19 غالب باقی مانده است، که تا حد زیادی با روش فعلی الکترولیز محلول های پتاسیم کلرید جایگزین شد. این روش مشابه ساخت هیدروکسید سدیم است.
KCl + 2 H2O → 2 KOH + Cl2 + H2
گاز هیدروژن به عنوان محصول جانبی روی کاتد تشکیل می شود. همزمان، یک اکسیداسیون آندی از یون کلرید اتفاق می افتد، و گاز کلر را به عنوان محصول جانبی تشکیل می دهد. جداسازی فضاهای آندی و کاتدی در سلول الکترولیز برای این فرآیند ضروری است.
خواص هیدروکسید پتاسیم
پتاسیم هیدروکسیدیک پایه قوی است البته از آن به عنوان پتاس سوزآور نیز یاد می شود. هیدروکسید پتاسیم معمولاً به عنوان یک ماده قلیایی شناخته می شود. هیدروکسید پتاسیم از نظر شیمیایی بسیار فعال است. پتاسیم هیدروکسید خوراکی به شدت با اسیدها واکنش نشان می دهد و مقدار قابل توجهی از گرما را در فرآیند تولید می کند. پتاسیم هیدروکسید صنعتی با انتشار گاز هیدروژن در هوای مرطوب قابل اشتعال و منفجره است. هیدروکسید پتاسیم همچنین باعث خوردگی فلزاتی مانند قلع، سرب، روی و آلومینیوم می شود. دانستن خواص مواد شیمیایی برای بهره برداری از آنها بسیار ضروری است و اطلاعات کافی در مورد خواص هیدروکسید پتاسیم این فرصت را به ما می دهد تا آگاهانه از خواص آن استفاده کنیم.
ساختار پتاسیم هیدروکسید
در دماهای بالاتر، KOH جامد در ساختار بلور NaCl متبلور می شود. گروه OH به سرعت یا به طور تصادفی دچار اختلال می شود.
پتاسیم یک فلز فعال است که به سرعت اکسید می شود و توانایی ساخت ترکیبات و اکسید شدن در پتاسیم بسیار مورد توجه بوده و هست. این توانایی پتاسیم به دلیل ساختار و الکترونهای لایه ظرفیت آن و همچنین شعاع اتمی فلز است.
خواص فیزیکی هیدروکسید پتاسیم
هیدروکسید پتاسیم یک جامد سفید با چگالی 12/2 گرم در میلی لیتر، نقطه ذوب 360 درجه سانتیگراد و نقطه جوش 1،327 درجه سانتیگراد است. پتاسیم هیدروکسید خوراکی به صورت گلوله های شفاف یا محلول های آبی با غلظت های مختلف در دسترس است. خرید پتاسیم هیدروکسید صنعتی یک ماده جامد سفید است. هیدروکسید پتاسیم در بلورهای سفید تا زرد موجود است. البته، با دانستن جرم مولی آن، که 56/11 مول است ؛ برای انجام آزمایشات، محاسبات و دانستن میزان هیدروکسید پتاسیم در محصولات حاوی آن، لازم است که خصوصیات مهم فیزیکی هر ماده را در نظر بگیریم.
کاربردهای هیدروکسید پتاسیم
-
تهیه نمک ها
از نظر قلیایی بودن، خرید پتاسیم هیدروکسید مایع با اسیدهای مختلف واکنش نشان می دهد و از این واکنش اسید و باز برای تولید نمک های پتاسیم استفاده می شود. این نمک ها، به نوبه خود، دارای کاربردهای مختلفی هستند. به عنوان مثال، فسفات های پتاسیم کود هستند، از کربنات در تولید صابون و شیشه، از سیانور در استخراج و آبکاری طلا استفاده می شود و پرمنگنات یک ضد عفونی کننده است.
-
خنثی سازی اسیدها
به عنوان یک قلیایی، از هیدروکسید پتاسیم برای خنثی سازی اسیدیته و تنظیم pH محلول ها استفاده می شود. در آنالیزهای شیمیایی، عامل تعیین کننده ای برای تیتراسیون اسیدها برای تعیین غلظت آنها است.
-
تولید صابون
واکنش هیدروکسید پتاسیم با روغنها و چربیها در شرایط گرم، صابون سازی نامیده می شود. این واکنش برای تولید صابون های پتاسیم که نرمتر و محلول تر از صابون های حاصل از هیدروکسید سدیم هستند، مفید است. در نتیجه، صابون های مایع تمایل به صابون های پتاسیم ای دارند، در حالی که صابون های جامد تمایل به صابون های سدیم ای دارند.
صابون های پتاسیم به دلیل نرمی و حلالیت بیشتر به آب کمتری برای مایع شدن احتیاج دارند و بنابراین می توانند ماده تمیز کننده بیشتری نسبت به صابون های سدیم مایع داشته باشند.
-
تولید باتری و سلول سوختی
از محلول آبی خرید پتاسیم هیدروکسید ایرانی به عنوان الکترولیت در انواع باتری ها از جمله باتری های قلیایی، نیکل-کادمیوم و دی اکسید منگنز-روی استفاده می شود. همچنین در انواع خاصی از پیل های سوختی الکترولیت است. محلول های خرید پتاسیم هیدروکسید رسانای بهتر برق نسبت به محلول های هیدروکسید سدیم هستند و بنابراین بر دومی ترجیح داده می شوند.
-
صنایع غذایی و خوراکی
در صنایع غذایی، ممکن است از خرید پتاسیم هیدروکسید خوراکی در فرآوری شکلات و کاکائو، تولید رنگ کارامل و شستشو و لایه برداری شیمیایی میوه ها و سبزیجات استفاده شود.
در محصولات غذایی، هیدروکسید پتاسیم به عنوان غلیظ کننده مواد غذایی، عامل کنترل pH و تثبیت کننده غذا عمل می کند. FDA در صورت استفاده مطابق با روشهای ساخت خوب، آن را به عنوان ماده غذایی مستقیم بی خطر می داند. در سیستم شماره E به E525 معروف است.
-
پیش ماده سایر ترکیبات پتاسیم
بسیاری از نمک های پتاسیم با واکنش های خنثی سازی مربوط به KOH تهیه می شوند. نمک های پتاسیم کربنات، سیانور، پرمنگنات، فسفات و انواع سیلیکات ها( مثل سدیم متاسیلیکات ) با تصفیه اکسیدها یا اسیدها با KOH تهیه می شوند. حلالیت زیاد فسفات پتاسیم در کودها مطلوب است.
-
به عنوان الکترولیت
کربنات پتاسیم، حاصل از محلول هیدروکسید نشتی باتری قلیایی است
خرید پتاسیم هیدروکسید ازمایشگاهی آبی به عنوان الکترولیت در باتری های قلیایی مبتنی بر نیکل-کادمیوم، نیکل-هیدروژن و دی اکسید منگنز-روی استفاده می شود. خرید پتاسیم هیدروکسید صنعتی به هیدروکسید سدیم ترجیح داده می شود زیرا محلول های آن رساناتر هستند. باتری های هیدرید نیکل و فلز موجود در تویوتا پریوس از مخلوطی از هیدروکسید پتاسیم و هیدروکسید سدیم استفاده می کنند. باتری های نیکل-آهن همچنین از الکترولیت هیدروکسید پتاسیم استفاده می کنند.
-
محصولات بهداشتی
برای تضعیف موی انسان در آماده سازی برای اصلاح نیز استفاده می شود. محصولات پیش اصلاح و برخی کرم های اصلاح حاوی هیدروکسید پتاسیم برای باز کردن کوتیکول مو و همچنین به عنوان یک ماده رطوبت زا برای جذب و تحمیل آب به ساقه مو عمل می کنند و باعث آسیب بیشتر به مو می شوند. در این حالت ضعیف، موها به راحتی توسط تیغ تراشیده می شوند.
-
کاربردهای گوناگون
- هیدروکسید پتاسیم یک کاتالیزور در فرآیند تولید بیودیزل از روغن و چربی است.
- در ساخت کاغذ، به جداسازی لیگنین از الیاف سلولز کمک می کند.
- این یک فرآورده در پردازش مرطوب نیمه هادی ها و یک ماده سفید کننده برای منسوجات است.
- می تواند برای جذب دی اکسید کربن (CO2)، تری اکسید گوگرد (SO3) و تری اکسید نیتروژن (NO3) در جریانهای گاز استفاده شود.
- خرید پتاسیم هیدروکسید خوراکی همچنین برای از بین بردن تخلیه زهکشی، از بین بردن مو از پوست حیوانات و حل لاشه حیوانات استفاده می شود.
- خواص خورنده خرید پتاسیم هیدروکسید صنعتی ، آن را به عنصر مفیدی در عوامل و آماده سازی سطوح و موادی که می توانند در برابر خوردگی توسط KOH مقاومت کنند، تمیز و ضد عفونی می کند.
- KOH همچنین برای ساخت تراشه نیمه هادی (به عنوان مثال اچ ناهمسانگرد مرطوب) استفاده می شود.
- هیدروکسید پتاسیم اغلب ماده اصلی فعال در “پاک کننده های کوتیکول” شیمیایی است که در درمان های مانیکور استفاده می شود.
ایمنی کار با پتاسیم هیدروکسید صنعتی
پتاسیم هیدروکسید صنعتی و محلول های آن تحریک کننده های شدیدی برای پوست و سایر بافت ها هستند.
نگهداری و ذخیره سازی
- اقدامات احتیاطی برای استفاده ایمن با احتیاط به کار بگیرید و ظرف را باز کنید.
- فقط با تهویه مناسب استفاده کنید.
- از هرگونه مواجهه خودداری کنید.
- بعد از دست زدن کاملاً آن ها را بشویید.
- شرایط نگهداری ایمن باشد.
- در مکانی با تهویه مناسب نگه دارید.
- ظروف را در محوطه ای خشک، خنک و دارای تهویه مناسب بسته نگه دارید.
- این مواد را از غذا، نوشیدنی و خوراک دام دور نگه دارید.
- در جابجایی / نگهداری مراقبت نمایید.
تفاوت سود و پتاس
سود و پتاس از مهمترین ترکیبات دسته هیدروکسیدها میباشند. این دسته از مواد که در صنعت نیز از اهمیت و کاربرد بالایی برخوردارند و در ساختار خود دارای گروه هیدروکسیل OHبوده که محلول های آن ها دارای خاصیت قلیایی و مزه تلخ بوده که می تواند اسید ها را خنثی و رنگلیتموس قرمز را به آبی تبدیل کند.
تفاوت میان سود (سدیم هیدروکسید) و پتاس (پتاسیم هیدروکسید ازمایشگاهی) تا اوایل قرن ۱۹ همچنان ناشناخته باقی مانده بود اگرچه شیمیدانان از زمان های قبل احتمال داده بودند که خاک های قلیایی دارای اکسیدهای فلزی باشند اما این تفاوت به طور قطع مشخص نشده بود حتی لاوازیه در این مورد نظر قطعی و معلومی نداشت و نمی دانست که جزء اصلی سود و پتاس چیست تنها در یک فرضیه حدس میزد که ازت یکی از اجزای تشکیل دهنده این مواد باشد.
تفاوت پتاس و سولوپتاس چیست؟
سولوپتاس یا همان سولفات پتاسیم محلول در آب از دسته ترکیبات پرکاربرد در صنایع کود شیمیایی و کشاورزی بوده که با ترکیب شیمیایی اکسید پتاسیم K2O 51% و گوگرد تری اکسید SO3 46% با نام تجاری سولوپتاس شناخته میشود.سولوپتاس ph سطح ریشه ها در خاکهای قلیایی و شور را کاهش داده و در نتیجه حلالیت و جذب فسفر آهن و ریز مغذی ها به وسیله ریشه گیاهان را تسهیل می کند.
عنصر پتاسیم در ساختار هیچ یک از گیاهان، برگ ها، درختان و میوه ها به صورت قابل توجه وجود ندارد اما همواره این عنصر نقش بسیار مهم در رشد گیاهان و درختان دارد. عنصر پتاسیم با افزایش سرعت انتقال کربوهیدرات ها آمینو اسید ها و ریز مغذی ها در تمامی بخش های گیاه مانند ساقه ها و برگ ها باعث افزایش سرعت رسیدن میوه ها شده و همچنین خرید پتاسیم هیدروکسید ایرانی باعث افزایش ضخامت دیواره ساقه ها میشود که در پی آن مقاوم شدن گیاه در برابر سرما و گرما حاصل میشود.
سولو پتاس که ترکیبی بسیار کاربردی در صنایع کود شیمیایی است برخلاف تشابه اسمی با پتاس (پتاسیم هیدروکسید خوراکی) دارای ترکیبات یکسان با آن نیست و مواد تشکیل دهنده و کاربردهای متفاوت دارد و به عنوان کودی کاملاً عاری از نیترات و ۱۰۰ درصد محلول در آب دارای پایینترین شاخص آبشویی و ضریب شوری نسبت به سایر کودها است که همه ساله در کشت انواع محصولات کشاورزی کاربرد های فراوانی دارد.
کود های دارای نیترات نیز برای بسیاری از گیاهان مورد نیاز است که شما میتوانید برای این کار از پتاسیم نیترات استفاده کنید.
کشورهای برتر تولید کننده پتاس بر اساس میزان و حجم تولید
- کانادا (کانادا با تولید پتاس در سال 2019 با رشد 1.3 میلیون MT نسبت به سطح تولید 2018، بزرگترین تولید کننده پتاس جهان است.)
- بلاروس
- روسیه
- چین
- آلمان
- اردن
- چین
- اسپانیا
- ایالات متحده
- کره جنوبی
منابع:
https://www2.atmos.umd.edu/~russ/MSDS/potassium_hydroxide.htm
https://pubchem.ncbi.nlm.nih.gov/compound/Potassium-hydroxide
https://sciencing.com/uses-potassium-hydroxide-5410923.html



3 دیدگاه دربارهٔ «خرید پتاسیم هیدروکسید;
با تشکر از اسید فرمیک برتر، که به طور مداوم نتایج استثنایی را ارائه می دهد و استانداردهای کیفیت سختگیرانه من را برآورده می کند.
قابلیت اطمینان این فروشنده آنها را از دیگران متمایز می کند. آنها انتخاب ترجیحی من برای مواد شیمیایی هستند.
متشکر از محتوای عالیتون