کاتالاز
Catalase یک آنزیم رایج است که تقریباً در تمام موجودات زنده در معرض اکسیژن (مانند باکتری ها ، گیاهان و حیوانات) وجود دارد. کاتالاز تجزیه پراکسید هیدروژن در آب و اکسیژن را کاتالیز می کند. این آنزیم بسیار مهم در محافظت از سلول در برابر آسیب اکسیداتیو توسط گونه های اکسیژن فعال (ROS) است. به همین ترتیب ، کاتالاز یکی از بالاترین تعداد گردش مالی آنزیم ها را داراست. یک مولکول کاتالاز می تواند میلیون ها مولکول پراکسید هیدروژن را در هر ثانیه به آب و اکسیژن تبدیل کند.
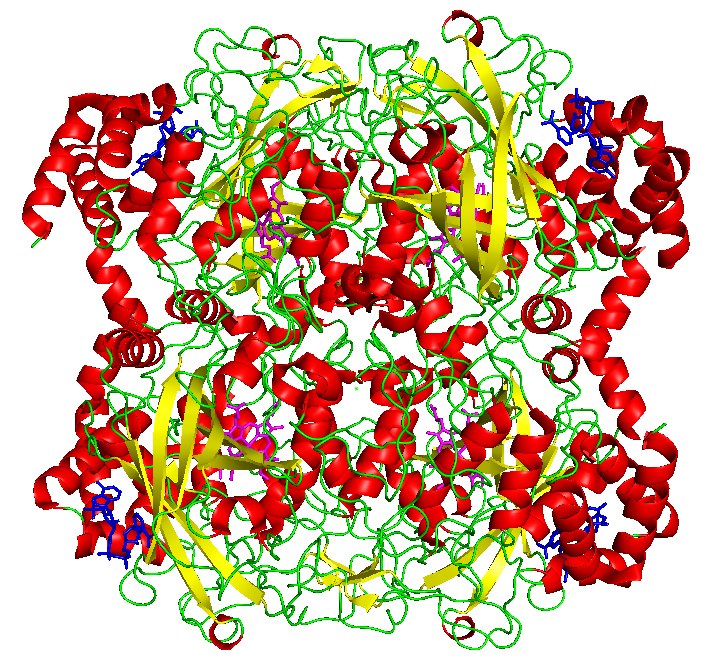
کاتالاز یک تترامر از چهار زنجیره پلی پپتیدی است که هر یک از آنها بیش از 500 اسید آمینه دارد. این چهار گروه هیم حاوی آهن است که به آنزیم اجازه می دهد با پراکسید هیدروژن واکنش نشان دهد. pH بهینه برای کاتالاز انسانی تقریباً 7 ، است و حداکثر نسبتاً گسترده ای دارد: میزان واکنش بین pH 6.8 و 7.5 به میزان قابل توجهی تغییر نمی کند. pH بهینه برای سایر کاتالازها بسته به نوع آن بین 4 تا 11 متغیر است. دمای مطلوب نیز بر حسب گونه ها متفاوت است.
ساختار آنزیم کاتالاز
کاتالاز انسان یک چهارگوش متشکل از چهار زیر واحد را تشکیل می دهد که هر یک از آنها به صورت مفهومی به چهار حوزه تقسیم می شوند. هسته اصلی هر زیر واحد توسط یک بشکه ضد رقیق چند رشته ای b-بشکه (b1-8) تولید می شود ، و نزدیکترین اتصال همسایه توسط حلقه های بشکه در یک طرف و حلقه های a9 از طرف دیگر محصور شده است. دامنه مارپیچ در یک وجه بشکه از چهار مارپیچ C ترمینال (a16 ، a17 ، a18 ، و a19 ) و چهار مارپیچ مشتق شده از مانده بین b4 و b5 ( a4 ، a5 ، a6 و a7 ) تشکیل شده است. ترکیب متناوب ممکن است به انواع پروتئین مختلف منجر شود.
تاریخچه
کاتالاز نخستین بار در سال 1818 مورد توجه قرار گرفت. هنگامیکه لوئیس ژاک فنر ، که پراکسید هیدروژن را کشف کرد ، اظهار داشت که تجزیه آن توسط یک ماده ناشناخته ایجاد می شود. در سال 1900 ، اسکار لوو اولین کسی بود که آن را کاتالاز نامید و آن را در بسیاری از گیاهان و حیوانات یافت. در سال 1937 ، کاتالاز از جگر گاو توسط جیمز بی سونر و الکساندر دونز متبلور شد و وزن مولکولی آن در سال 1938 یافت شد.
توالی اسید آمینه کاتالاز گاوی در سال 1969 ، و ساختار سه بعدی در سال 1981 تعیین شد.
عملکرد آنزیم کاتالاز
واکنش
2 H 2 O2 → 2 H 2 O + O 2
وجود کاتالاز در یک نمونه میکروبی یا بافتی می تواند با افزودن پراکسید هیدروژن و مشاهده واکنش نشان داده شود. با تولید حباب ها می توان تولید اکسیژن را مشاهده کرد. این تست آسان که با چشم غیر مسلح و بدون کمک ابزار قابل مشاهده است ، امکان پذیر است زیرا کاتالاز فعالیت خاص بسیار بالایی دارد ، که یک واکنش قابل تشخیص را ایجاد می کند ، همچنین این واقعیت را دارد که یکی از محصولات گاز است.
مکانیسم مولکولی
در حالی که مکانیسم کامل کاتالاز در حال حاضر مشخص نیست ، اعتقاد بر این است که این واکنش در دو مرحله رخ می دهد:
H 2 O 2 + Fe (III) -E → H 2 O + O = Fe (IV) -E (. +)
H 2 O 2 + O = Fe (IV) -E (. +) → H 2 O + Fe (III) -E + O2
در اینجا آهن () – E نشان دهنده مرکز آهن گروه هیم متصل به آنزیم است. آهن (IV) -E (. +) یک فرم مزومریک از Fe (V) -E است ، به این معنی که آهن کاملاً به + V اکسیده نمی شود ، اما مقداری چگالی الکترونی تثبیت کننده را از لیگ هما دریافت می کند ، که بعداً به عنوان کاتیون رادیکال (. +). نشان داده می شود.
با ورود پراکسید هیدروژن به محل فعال ، با اسیدهای آمینه Asn148 (آسپاراگین در موقعیت 148) و His75 در تعامل است و باعث می شود پروتون ( یون هیدروژن) بین اتم های اکسیژن انتقال یابد. اتم اکسیژن آزاد مختصراً ، مولکول آب تازه تشکیل شده و آهن (IV) = O را آزاد می کند. آهن (IV) = O با یک مولکول پراکسید هیدروژن دوم برای اصلاح آهن (III) -E و تولید آب و اکسیژن واکنش نشان می دهد. واکنش پذیری مرکز آهن ممکن است با حضور لیگاند فنلی Tyr358 در موقعیت هماهنگی پنجم ، که می تواند در اکسیداسیون آهنIII)) به آهن (IV ) کمک کند ، بهبود یابد. بازده واکنش نیز ممکن است با اثر متقابل His75 و Asn148 با واسطه های واکنش بهبود یابد. تجزیه پراکسید هیدروژن توسط کاتالاز طبق سینتیک مرتبه اول انجام می شود ، این میزان متناسب با غلظت پراکسید هیدروژن است.
هر یون فلزی سنگین (مانند کاتیونهای مس در سولفات مس(II) ) می تواند به عنوان یک مهار کننده غیرقابل رقابت کاتالاز عمل کند. علاوه بر این ، سیانید سمی یک مهار کننده غیر رقابتی کاتالاز در غلظت های بالای پراکسید هیدروژن است. آرسنات به عنوان یک فعال کننده عمل می کند. ساختار پروتئین سه بعدی واسطه های کاتالاز پراکسیده شده در بانک داده پروتئین در دسترس هستند.
نقش کاتالاز در سلول
پراکسید هیدروژن یک محصول جانبی مضر در بسیاری از فرآیندهای متابولیک طبیعی است. برای جلوگیری از آسیب رساندن به سلول ها و بافت ها ، باید سریعاً به موادی با خطر کمتر تبدیل شود. برای این منظور ، کاتالاز اغلب توسط سلولها مورد استفاده قرار می گیرد تا سریعاً تجزیه پراکسید هیدروژن به اکسیژن گازی با فعالیت کم و مولکولهای آب را کاتالیز کند.
از نظر ژنتیکی موشهایی که فاقد کاتالاز هستند از نظر فنوتیپی طبیعی هستند. ، با این حال ، کمبود کاتالاز در موشها احتمال ابتلا به چاقی ، کبد چرب ، و دیابت نوع 2 را افزایش می دهد. برخی از انسانها سطح کاتالاز ( آکاتالازی ) بسیار کمی دارند ، اما هنوز اثرات کمی دارند.
افزایش استرس اکسیداتیو که با پیری در موش ها رخ می دهد با بیان بیش از حد کاتالاز کاهش می یابد. موش های با بیان بیش از حد ، از بین رفتن سن اسپرماتوزوها ، جوانه بیضه ها و سلول های سرتولی( در موش های نوع وحشی) را نشان نمی دهند. استرس اکسیداتیو در موش های نوع وحشی به طور مرتب باعث آسیب DNA اکسیداتیو (اندازه گیری شده به عنوان 8-oxodG ) در اسپرم با افزایش سن می شود ، اما این آسیب ها به طور قابل توجهی در موش های با بیان بیش از حد کاتالاز کاهش می یابد. علاوه بر این ، این موش های با بیان بیش از حد کاهش در تعداد نوزادان وابسته به سن را در هر بستر نشان نمی دهند. بیان بیش از حد کاتالاز که به میتوکندری اختصاص داده شده است طول عمر موشها را افزایش می دهد.
کاتالاز معمولاً در اندامک سلولی به نام پراکسیزوم قرار دارد . پراکسیزومها در سلولهای گیاهی در تنفس عکس العمل (استفاده از اکسیژن و تولید دی اکسید کربن) و تثبیت نیتروژن همزیوتیک (جدا شدن ازت ازت دیاتومیک (N 2 ) به اتمهای فعال نیتروژن) نقش دارند. پراکسید هیدروژن به عنوان یک عامل ضد میکروبی قوی در هنگام آلوده شدن سلول ها به یک بیماری زا استفاده می شود. پاتوژن های مثبت کاتالاز ، مانند مایکوباکتریوم توبرکلوزیس ، Legionella pneumophila و Campylobacter jejuni ، برای غیرفعال کردن رادیکال های پراکسید پاتوژن ، کاتالاز را ساخته و از این طریق به آنها اجازه زنده ماندن در داخل میزبان را نمی دهند .
مانند الکل دهیدروژناز الکل ، کاتالاز اتانول را به استالدهید تبدیل می کند ، اما بعید است که این واکنش از نظر فیزیولوژیکی دارای اهمیت باشد.
توزیع در بین ارگانیسم ها
اکثریت ارگانیسم های شناخته شده از کاتالاز در هر اندام استفاده می کنند ، که غلظت های خاصی به خصوص در کبد پستانداران وجود دارد. تقریباً همه میکروارگانیسم های هوازی از کاتالاز استفاده می کنند. همچنین در برخی میکروارگانیسم های بی هوازی مانند Methanosarcina barkeri وجود دارد . کاتالاز در بین گیاهان نیز جهانی است و در بیشتر قارچ ها مشاهده می شود .
یک استفاده منحصر به فرد از کاتالاز در سوسک بمب افکن رخ می دهد. این سوسک دو مجموعه مایعات دارد که بطور جداگانه در دو جفت غده ذخیره می شود. غده ی بزرگتر این جفت ، محفظه انبار یا مخزن ، حاوی هیدروکینون ها و پراکسید هیدروژن است ، در حالی که غده ی کوچکتر ، محفظه واکنش ، حاوی کاتالازها و پراکسیدازها است . برای فعال کردن اسپری مضر ، سوسک محتویات دو محفظه را مخلوط می کند و باعث می شود اکسیژن از پراکسید هیدروژن آزاد شود. اکسیژن هیدروکینون ها را اکسیده می کند و همچنین به عنوان پیشران عمل می کند. واکنش اکسیداسیون بسیار گرماده (ΔH = 202.8 کیلوژول در مول) است و به سرعت مخلوط را تا نقطه جوش گرم می کند.
ملکه های موریانه Reticulitermes speratus نسبت به افراد غیر تولید مثل کننده (کارگران و سربازان) آسیب اکسیداتیو به میزان قابل توجهی پایین تر از DNA دارند. کوئین ها بیش از دو برابر فعالیت کاتالاز و هفت برابر بیشتر از میزان بیان ژن کاتالاز RsCAT1 نسبت به کارگران دارند. به نظر می رسد که قابلیت آنتی اکسیدانی کارآمد ملکه های موریانه تا حدی می تواند چگونگی دستیابی به عمر طولانی تر را توضیح دهد.
آنزیم های کاتالاز از گونه های مختلف ، دمای مطلوب بسیار متفاوت دارند. حیوانات Poikilothermic به طور معمول کاتالازهایی با دمای مطلوب در دامنه 15-25 درجه سانتیگراد دارند ، در حالی که کاتالیز پستانداران یا مرغی ممکن است دمای مطلوب بالاتر از 35 درجه سانتیگراد ، و خرید کاتالازهای حاصل از گیاهان بسته به عادت رشد آنها متفاوت باشد. در مقابل ، خرید کاتالاز جدا شده از آرکیون هیپرتروموفیل Pyrobaculum calidifontis دارای دمای مطلوب 90 درجه سانتی گراد است.
اهمیت بالینی و کاربردی
خرید کاتالاز در صنایع غذایی برای از بین بردن پراکسید هیدروژن از شیر قبل از تولید پنیر استفاده می شود. استفاده دیگر در مواد بسته بندی مواد غذایی است که در آن از اکسیداسیون مواد غذایی جلوگیری می کند. همچنین خرید کاتالاز در صنعت نساجی نیز استفاده می شود و پراکسید هیدروژن را از پارچه ها خارج می کند تا مطمئن شود مواد عاری از پراکسید هستند.
یکی از استفاده ها در بهداشت لنزهای تماسی است .ابتدابا استفاده از چند محصول تمیز کننده لنز از محلول پراکسید هیدروژن لنزها را ضد عفونی می کنند. سپس محلول حاوی کاتالاز را برای تجزیه پراکسید هیدروژن قبل از استفاده مجدد از لنز استفاده می کنند.
شناسایی باکتریایی (آزمایش کاتالاز)
واکنش مثبت کاتالاز
آزمایش کاتالاز یکی از سه آزمایش اصلی است که توسط میکروبیولوژیست ها برای شناسایی گونه های باکتری مورد استفاده قرار گرفته است. اگر باکتری ها دارای خرید کاتالاز باشند (مثلاً کاتالاز مثبت است) ، وقتی مقدار کمی از باکتری جداشده به پراکسید هیدروژن اضافه می شود ، حباب اکسیژن مشاهده می شود. آزمایش خرید کاتالاز با قرار دادن قطره پراکسید هیدروژن در یک اسلاید میکروسکوپ انجام می شود . با یک چوب اپلیکاتور کلونی باکتری لمس می شود ، و نوک آن را روی قطره پراکسید هیدروژن قرار می دهند.
اگر این مخلوط حباب یا کف ایجاد کند ، به ارگانیسم گفته می شود که “کاتالاز مثبت” است. استافیلوکوکها و میکروکوکها مثبت از نظر خرید کاتالاز هستند. سایر ارگانیسم های مثبت به خرید کاتالاز شامل لیستریا ، Corynebacterium diphtheriae ، Burkholderia cepacia ، Nocardia ، خانواده Enterobacteriaceae ( سیتروباکتر ، E.coli ، انتروباکتر ، کلبسیلا ، شیگلا ، یرسینیا ، پروتئوس ، سالمونلا ، سراتیا ، توبوسپوروس ، آسپیروسپوس ، ماوس و Rhodococcus equi .اگر اینگونه نباشد ، ارگانیسم “منفی کاتالاز” است. استرپتوکوک و انتروکوکوس spp. خرید کاتالاز منفی هستند.
در حالی که آزمایش خرید کاتالاز به تنهایی نمی تواند ارگانیسم خاصی را شناسایی کند ، می تواند هنگام ترکیب با آزمایش های دیگر مانند مقاومت آنتی بیوتیکی به شناسایی کمک کند. وجود خرید کاتالاز در سلولهای باکتریایی هم به شرایط رشد و هم به محیط مورد استفاده برای رشد سلول بستگی دارد.
همچنین ممکن است از لوله های مویرگی استفاده شود. برای جلوگیری از نتایج منفی کاذب ، نمونه کوچکی از باکتری ها در انتهای لوله مویرگی ، بدون انسداد لوله جمع آوری می شود. سپس انتهای مخالف درون پراکسید هیدروژن فرو می رود که از طریق عمل مویرگی به داخل لوله کشیده می شود و وارونه می شود ، به طوری که نمونه باکتری به سمت پایین قرار می گیرد. سپس دستی که لوله را نگه می دارد روی نیمکت قرار می گیرد و پراکسید هیدروژن را به سمت پایین حرکت می دهد تا اینکه باکتری ها را لمس کند. اگر حباب در تماس باشد ، این نتیجه مثبت خرید کاتالاز را نشان می دهد. این آزمایش می تواند باکتریهای مثبت به خرید کاتالاز را در غلظتهای بالاتر از حدود 10 5سلول در میلی لیتر تشخیص دهد ، و کاربرد آن بسیار ساده است.
ویروس باکتریایی
نوتروفیل ها و فاگوسیت های دیگر از پراکسید برای از بین بردن باکتری ها استفاده می کنند. آنزیم NADPH اکسیداز سوپراکسید را در فاگوزوم تولید می کند ، که از طریق پراکسید هیدروژن به سایر مواد اکسید کننده مانند اسید هیپوکلروز تبدیل شده و عوامل بیماری زای فاگوسیتوز را از بین می برد . در افراد مبتلا به بیماری گرانولوماتوز مزمن (CGD) نقص در تولید پراکسید از طریق جهش در اکسیدازهای فاگوسیت مانند میلوپراکسیداز وجود دارد . متابولیسم سلولی معمولی هنوز مقدار کمی پراکسید تولید می کند و از این پراکسید می توان برای تولید اسید هیپوکلروز برای ریشه کن کردن عفونت باکتریایی استفاده کرد. اما اگر افراد مبتلا به CGD به باکتریهای مثبت به خرید کاتالاز آلوده شوند ، قبل از استفاده از آن برای تولید سایر اکسید کننده ها ، کاتالیز باکتریایی می تواند پراکسید اضافی را از بین ببرد. در این افراد پاتوژن زنده مانده و به یک عفونت مزمن تبدیل می شود. این عفونت مزمن معمولاً در تلاش برای جداسازی عفونت توسط ماکروفاژها احاطه شده است. این دیواره ماکروفاژها که در اطراف پاتوژن وجود دارد گرانولوم نامیده می شود. بسیاری از باکتریها از نظر خرید کاتالاز مثبت هستند ، اما برخی از آنها نسبت به بقیه از نظر تولیدکننده خرید کاتالاز بهتر هستند. “گربه ه نیاز به PLACESS دارند تا موهایشان را جمع کنند” برای حفظ باکتری های مثبت خرید کاتالاز (و کاندیدا و آسپرژیلوس که قارچ ها هستند) می توانند مورد استفاده قرار بگیرند: نوکاردیا ، شبه دمانس ، لیستریا ، آسپرژیلوس ، کاندیدا ، E. coli ، استافیلوکوک ، سراتیا ، B. cepacia و H. pylori .
Acatalasia
آکاتالازیا شرایطی است که در اثر جهش هموزیگوت در CAT ایجاد می شود و در نتیجه کاتالاز وجود ندارد. علائم آن خفیف است و شامل زخمهای دهانی نیز می شود. جهش CAT هتروزیگوت منجر به کاتالاز پایین اما در عین حال موجود می شود.
اصلاح موهای خاکستری
مقادیر کم خرید کاتالاز ممکن است در روند خاکستری شدن موهای انسان نقش داشته باشد. پراکسید هیدروژن به طور طبیعی توسط بدن تولید می شود و توسط خرید کاتالاز تجزیه می شود. اگر سطح خرید کاتالاز کاهش یابد ، پراکسید هیدروژن نمی تواند به خوبی تجزیه شود. پراکسید هیدروژن در تولید ملانین اختلال ایجاد می کند ، همان رنگدانه ای که به مو رنگ می بخشد.
تعامل
نشان داده شده است که کاتالاز با ژنهای ABL2 و Abl در تعامل است . عفونت با ویروس لوسمی موش باعث کاهش فعالیت خریدکاتالاز در ریه ها ، قلب و کلیه موش ها می شود. در مقابل ، روغن ماهی رژیم غذایی باعث افزایش فعالیت خرید کاتالاز در قلب و کلیه های موش ها شد.










8 دیدگاه دربارهٔ «خرید انزیم کاتالاز ازمایشگاهی به همراه انالیز کالا;
من از عرضه مداوم اسید بوریک، که یک عنصر قابل اعتماد و موثر در فرمولاسیون من بوده و به کیفیت محصولات من کمک می کند، سپاسگزارم.
اطلاعات باید از چندین منبع بررسی بشه،مرسی از زحمات شما
با سلام ودرود اگر امکان داره منابع اطلاعات درج شده را ذکر کنید
آیا کاتالاز جز آنزیم های آلوستریک است یا غیر الوستریک؟
سلام
اطلاعی ندارم
ممنون، اطلاعات شما کمک بزرگی بود
خوشحالم که تونستیم کمکی کرده باشیم
میشه فرمول شیمیایی کاتالاز و بنویسید