کاتالیزگر چیست ؟
به هر ماده ای که میزان سرعت واکنش را افزایش دهد ودر انتهای واکنش مصرف نشده باقی بماند کاتالیزگر می گویند. آنزیم ها به طور طبیعی کاتالیزگرهایی هستند که مسئولیت کاتالیز بسیاری از واکنش های بیوشیمیایی اساسی در بدن را بر عهده دارند.
کاتالیزگر در شیمی
کاتالیزگر در شیمی وظیفه تغییر نرخ پیشرفت یک واکنش شیمیایی را بر عهده دارد که معمولا باعث شتاب گرفتن واکنش ها می شود، با این وجود در پایان واکنش دست نخورده باقی می ماند. میزان پیشرفت واکنش های شیمیایی- یعنی سرعت مصرف واکنش دهنده ها – به عواملی همچون ، ماهیت شیمیایی گونه های واکنش دهنده و شرایط خارجی که در معرض آن قرار دارند بستگی دارد. یک پدیده خاص در ارتباط با میزان پیشرفت واکنش های شیمیایی که از نظر تئوری و عملی بسیار مورد توجه است ، تسریع در روند واکنش های شیمیایی توسط موادی که در خود واکنش ها مصرف نمی شوند ، می باشد – مواد شناخته شده در این زمینه را به عنوان کاتالیزگر می شناسند.
در واکنش کاتالیز شده ، کاتالیزگر بطور کلی با ترکیبات شیمیایی درگیر می شود اما در نهایت بازسازی شده و دست نخورده باقی می ماند. از آنجایی که کاتالیزگرها مصرف نمی شوند ، هر مولکول کاتالیزگر ممکن است باعث تحریک بسیاری از مولکول های واکنش دهنده شود. برای یک کاتالیزگر فعال ، تعداد مولکول های تغییر یافته در دقیقه توسط یک مولکول کاتالیزگر ممکن است به اندازه چندین میلیون مولکول باشد.
در جایی که یک ماده معین یا ترکیبی از مواد تحت دو یا چند واکنش همزمان قرار بگیرد که هر کدام محصولات مختلفی را به همراه دارد ، توزیع محصولات ممکن است تحت تأثیر استفاده از یک کاتالیگر تغییر کند، که به طور انتخابی یک واکنش نسبت به دیگری از سرعت پیشرفت بالاتری برخوردار شود . با انتخاب کاتالیزگر مناسب ، می توان یک واکنش آن چنان تسریع کرد که گویا واکنش ها موازی با آن انگار انجام نمی شوند. بسیاری از کاربردهای مهم تجزیه و تحلیل مبتنی بر انتخاب کاتالیزگر از این نوع است.
اهمییت کاتالیزگر
از نظر تئوری مطالعه کاتالیزگرها مورد توجه است زیرا آنچه در مورد ماهیت اصلی واکنش های شیمیایی وجود دارد را مشخص می کند. از نقطه نظر عملی نیز ، مطالعه کاتالیزگرها از اهمیت ویژه ای برخوردار است ، زیرا بسیاری از فرآیندهای صنعتی برای موفقیت به کاتالیزگرها وابسته هستند. اساساً ، فعل و انفعالات عجیب و غریبی که باعث حیات ما می شوند بدون وجود آنزیم ها که همان نقش کاتالیزگرها را در بدن ما بازی می کنند غیر قابل پیشرف هستند.
تاثیر کاتالیزگر بر تعادل واکنش
از آنجا که یک واکنش شیمیایی معکوس ممکن است با برگرداندن مراحل تشکیل مکانیسم واکنش رو به عقب پیش برود ، کاتالیزگر برای یک واکنش معین واکنش را در هر دو جهت به همان اندازه تسریع می کند. بنابراین ، یک کاتالیزگر روی موقعیت تعادل یک واکنش شیمیایی تأثیر نمی گذارد. این تنها بر میزان دستیابی به تعادل واکنش تأثیر می گذارد. استثنائات ظاهری از این تعمیم آن واکنش هایی است که در آن یکی از محصولات همچنین کاتالیزگر واکنش است. چنین واکنش هایی اتوکاتالیستی نامیده می شوند.
مهارکننده ها
مواردی نیز شناخته شده است که در آن افزودن ماده خارجی به نام مهار کننده ، میزان واکنش یک ماده شیمیایی را کاهش می دهد. این پدیده ، مهار یا عقب ماندگی نامیده می شود ، گاهی اوقات کاتالیز منفی نیز نامیده می شود. غلظت بازدارنده در بعضی موارد ممکن است بسیار پایین تر از واکنش دهنده ها باشد. مهار ممکن است از :
(1) کاهش غلظت یکی از واکنش دهنده ها به دلیل تشکیل پیچیده فعال بین واکنش دهنده و بازدارنده باشد ،
(2) کاهش غلظت یک کاتالیزور فعال به دلیل تشکیل پیچیده فعال بین کاتالیزگر و مهار کننده ،
(3) خاتمه یک واکنش زنجیره ای به دلیل تخریب حامل های زنجیره ای توسط مهار کننده
تاریخچه کاتالیزگرها
اصطلاح کاتالیز (از کلمات یونانی کاتا ، “پایین” ، و لاین ، “شل شدن”) اولین بار در سال 1835 توسط شیمیدان بزرگ سوئدی “جانس یعقوب برزلیوس” به کار گرفته شد تا برخی از مشاهدات سایر شیمیدان ها را در اواخر قرن 18 و اوایل قرن 19 به هم پیوند دهد. در قرن نوزدهم این مشاهدات شامل تسریع تبدیل نشاسته به قند توسط اسیدها بود که برای اولین بار توسط “کنستانتین کیروشهف ” مشاهده شد.
مشاهدات “همفری دیوی” مبنی بر اینکه پلاتین احتراق انواع گازها را تسریع می کند، کشف ثبات هیدروژن پراکسید در محلول اسید اما تجزیه آن در حضور باز و فلزاتی مانند منگنز ، نقره ، پلاتین و طلا؛ و مشاهده اینکه اکسیداسیون الکل به استیک اسید در حضور پلاتین کاملاً تقسیم شده انجام می شود. عوامل ترویج این واکنشهای مختلف ، کاتالیزگر نامیده می شدند ، و “برزلیوس” یک نیروی کاتالیزوری ناشناخته ویژه را برای فعالیت در چنین فرآیندی فرض کرد.
در سال 1834 ، دانشمند انگلیسی “مایکل فارادی” قدرت یک صفحه پلاتینی را برای انجام ترکیب هیدروژن گازی و اکسیژن (محصولات الکترولیز آب) و عقب ماندگی آن ،ترکیب با حضور سایر گازها مانند اتیلن و کربن بررسی کرده بود. “مایکل فارادی” اظهار داشت که برای فعالیت ، یک سطح فلزی کاملاً تمیز (که در آن گازهای مهارکننده می توانند با گازهای واکنش دهنده و فعالیت سرکوبگرانه رقابت کنند) ضروری است ، مفهومی که بعداً نشان داده می شود که در کاتالیست واکنش ها بسیار مهم است.
مفهموم سرعت واکنش و کاتالیزگر
در سال 1850 مفهوم سرعت واکنش در طی مطالعات هیدرولیز یا وارونگی قند نیشکر توسعه یافت. اصطلاح وارونگی به تغییر چرخش تحت تأثیر نور تک رنگ هنگام عبور از طریق سیستم واکنش ، پارامتری که به راحتی اندازه گیری می شود ، اشاره دارد و در نتیجه مطالعه واکنش را تسهیل می کند. مشخص شد که هر لحظه میزان وارونگی متناسب با میزان قند نیشکر تحت تحول بوده و سرعت با حضور اسیدها بالا می رود. (بعداً مشخص شد که میزان وارونگی مستقیماً با غلظت اسید متناسب است.) این کار تا حدودی شروع مطالعات بعدی در مورد سرعت واکنش و دمای بالاتر در تسریع واکنش توسط J.H بود.. کار اوستوالد در زمینه سرعت واکنش باعث شد تا او در دهه 1890 کاتالیزورها را به عنوان موادی تعریف کند که سرعت یک واکنش شیمیایی معین را با تغییر در فاکتور های انرژی واکنش می تواند تغییر دهد.
این گفته اوستوالد یک پیشرفت به یاد ماندنی بود زیرا نشان می دهد که کاتالیزگرها در یک واکنش موقعیت تعادل را تغییر نمی دهند.
انواع کاتالیزگرها
ممکن است کاتالیزگرها را طبق وضعیت بدنی ، ماهیت شیمیایی آنها یا ماهیت واکنش هایی که کاتالیز می کنند ، طبقه بندی شوند.
کاتالیزگرها می توانند گازها ، مایعات یا مواد جامد باشند. در کاتالیز همگن ، کاتالیزگر از نظر مولکولی در همان فاز (معمولاً گازی یا مایع) واکنش دهنده ها پراکنده می شود. در کاتالیز ناهمگن ، واکنش دهنده ها و کاتالیزگر در فازهای مختلفی قرار دارند که با یک مرز فاز از هم جدا می شوند. معمولاً ، کاتالیزگرهای ناهمگن جامد هستند و واکنش دهنده ها گازها یا مایعات هستند.
کاتالیز همگن
هنگامی که کاتالیزگر و مواد واکنش دهنده در یک فاز معین معمولاً به عنوان گاز یا مایع در کنار هم قرارگیرند ، واکنش را به عنوان مواردی از کاتالیز همگن طبقه بندی می شود. اکسیدهای ازت به عنوان کاتالیزگر برای اکسیداسیون دی اکسید گوگرد در فرآیند محفظه سرب برای تولید اسید سولفوریک ، نمونه ای از کاتالیز همگن که در آن کاتالیزگر و واکنش دهنده ها گاز هستند.
بخار آب برخی واکنش های گاز را کاتالیز می کند – برای مثال ، واکنش متقابل مونوکسید کربن و اکسیژن ، که فقط در شرایط خشک به آرامی ادامه می یابد. اسید سولفوریک که به عنوان یک کاتالیزگر برای تشکیل دی اتیل اتر از اتیل الکل استفاده می شود نمونه ای از کاتالیگر همگن در فاز مایع است .(هنگامی که محصولات ، آب و اتر به طور مداوم با تقطیر برداشته می شوند). با این روش مقادیر قابل توجهی الکل با یک بار استفاده اسید سولفوریک به اتر تبدیل می شود. وارونگی قند نیشکر و هیدرولیز استرها توسط محلولهای اسیدی نیز نمونه هایی از کاتالیز همگن در فاز مایع است.
کاتالیز ناهمگن
بسیاری از فرآیندهای کاتالیزوری شناخته شده اند که در آن کاتالیزگر و واکنش دهنده ها هم فاز نیستند . این ها به عنوان واکنش های کاتالیزوری ناهمگن شناخته می شوند. این واکنش ها شامل واکنش های بین گازها یا مایعات یا هر دو در سطح یک کاتالیزگر جامد هستند. از آنجا که سطح جایی است که در آن واکنش انجام می شود ، به طور کلی به روش هایی انجام می شود که باعث ایجاد مناطق بزرگ در واحد سطح کاتالیگر شود. فلزات ریز شده ، گازهای فلزی ، فلزات موجود در ماتریسهای پشتیبانی ، و فیلمهای فلزی همه در کاتالیز ناهمگن مدرن استفاده شده اند. خود فلزاتی کهمورد استفاده قرار می گیرند به اکسیدها ، سولفیدها یا هالیدها تبدیل می شوند.
کاتالیزگر در پلیمریزاسیون
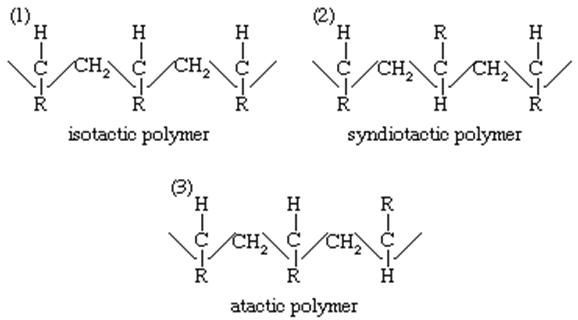
اهمیت مفهوم جذب بر روی سطح کاتالیزگرها با توسعه فرآیندهای پلیمریزاسیون افزایش یافته است یعنی روشهایی که پلیمرهایی را ارائه می دهند که مولکول های آن ها الگوهای سه بعدی قطعی دارند. چنین فرآیندهایی به طور مستقل توسط شیمیدان آلمانی “کارل زیگلر “و ایتالیایی Giulio” Natta “انجام شد. نمونه ای از پلیمریزاسیون پروپیلن با یک کاتالیزگر آلومینیوم تری کلرید آلکیل تیتانیوم است. در مورد یک ترکیب اتیلنی عمومی ، CH2 = CHR ، پلیمریزاسیون استریورژولار ممکن است سه ترتیب مختلف از پلیمر را به همراه داشته باشد: یک پلیمر ایزوتاکتیک ، یک پلیمر syndiotactic و یک پلیمر آکتاتیک. اینها ترتیب زیر از زنجیره های مولکولی آنها را دارند:
در پلیمر ایزوتاکتیک واحدهای مونومر سر به دم اضافه کرده اند تا یک سری ازC-R ها با همان تنظیم در فضا ارائه دهند. در پلیمر syndiotactic ، اتم های کربن سوم در زنجیره تنظیمات مکانی متناوب (دکسترو و لوو) دارند. و در پلیمر اتکتیک هیچ نظمی در توزیع تنظیمات استریکی اتمهای کربن نامتقارن وجود ندارد. اشکال مختلف پلیمری در خصوصیات بدنی آنها متفاوت است.
به عنوان مثال ، پلی پروپیلن ایزوتاستیک دارای چگالی 0.92 گرم در سانتی متر مکعب (0.53 اونس در اینچ مکعب) و نقطه ذوب 165 درجه سانتیگراد (329 درجه فارنهایت) است ، در حالی که یک پلیمر آکتتیک دارای چگالی کمی کمتر، 0.85 گرم درسانتی متر مکعب است. (0.49 اونس در هر اینچ مکعب) ، و یک نقطه ذوب بسیار پایین تر از 35 درجه سانتیگراد (30 درجه فارنهایت). پلیمر ایزوتاکتیکی منظم تر متراکم تر است و به دلیل تمایل بیشتر به تبلور ، از نقطه ذوب بالاتری نسبت به محصول آکتیک برخوردار است (به رغم این واقعیت که جانشین R ممکن است کاملاً بزرگ باشد و مانع تشکیل کریستال می شود).
کاتالیزورهای بیولوژیکی: آنزیم ها
آنزیم ها موادی هستند که در سیستم های بیولوژیکی یافت می شوند و برای فرآیندهای بیوشیمیایی خاص کاتالیزگر هستند. اگرچه اکتشافاتی در مورد آنزیم ها انجام شده است ، اما تأیید قابل توجهی در مورد اهمیت آنها در سیستم های زنده در سال 1897 توسط شیمیدان آلمانی “ادوارد بوخنر” پیدا شد.
از آن زمان بیش از 1000 آنزیم به رسمیت شناخته شده است ، که هر یک کاتالیزگر برای یک واکنش شیمیایی خاص است که در سیستم های زنده رخ می دهد. بیش از 100 مورد از آنها به شکل نسبتاً خالص به صورت متبلور جدا شده اند. اولین آنزیمهایی که تبلور یافته اند اورهاز بودند ، پپسین در سال 1930 توسط جان هوارد نورثروپ تبلور یافت. این مواد خالص به عنوان پروتئین compounds ترکیبات زنجیره ای تشکیل شده از 20 مدل اسید آمینه طبیعی اعم از ساده ترین ، گلیسین ، که در آن R هیدروژن است ، تا تریپتوفان ، نشان داده شده است
یک مثال برای استفاده کاتالیزور در صنعت (روغن نباتی)
ادامه توضیحات بالا با تمرکز روی کاتالیست
(توسط مهندس مهدی جوادی)
منبع این مثال : https://lipidlibrary.aocs.org/edible-oil-processing/hydrogenation-in-practice
مسمویت کاتالیزگر
سم کاتالیزگر ، ماده است که باعث کاهش کارایی کاتالیزگر در واکنش شیمیایی می شود. از نظر تئوری ، از آنجا که کاتالیزگرها در واکنشهای شیمیایی مصرف نمی شوند ، می توان آنها را بطور مکرر در مدت زمان نامشخص استفاده کرد. اما در عمل سمومی که از مواد واکنش دهنده یا محصولات خود واکنش تولید می شود ، روی سطح کاتالیزگرهای جامد جمع می شوند و باعث کاهش اثربخشی آنها می شوند. به همین دلیل ، هنگامی که اثربخشی یک کاتالیزگر به سطح پایین خاصی رسیده باشد ، اقدامات لازم برای از بین بردن سم یا پر کردن مؤلفه های فعال کاتالیزگر که ممکن است با سم واکنش نشان داده باشد ، انجام می شود.
سموم معمولاً با کربن موجود در کاتالیزگر سیلیس و آلومینا در ترک خوردن نفت واکنش می دهند. گوگرد ، آرسنیک یا سرب در کاتالیزگرهای فلزی در واکنش هیدراسیون یا هیدروژن زدایی و اکسیژن و آب موجود در کاتالیزگرهای آهن مورد استفاده در سنتز آمونیاک انواع مسمویت های کاتالیزگرها هستند.
نویسنده : مهندس سید محسن حداد
منبع : catalyst