آمونیاک (Ammonia)
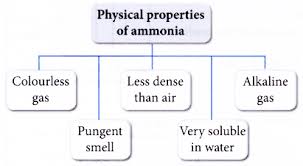
آمونیاک به انگلیسی Ammonia، یکی از مهم ترین ترکیب های هیدروژنه ازت دار و ساده ترین هیدرید گروه نیتروژن با جرم مولکولی ۰۳۱/۱۷ گرم بر مول و فرمول مولکولی NH3 است که حاصل تجزیه مواد آلی ازت دار می باشد. آمونیاک یک گاز قلیایی بی رنگ، با بوی فوق العاده تند، زننده، نافذ و شدید است که از هوا سبک تر بوده و راحت تر به مایع تبدیل می شود. این ماده در تماس با مجاری تنفسی سبب تحریک و اختلال می شود و به فرد آسیب می زند. همچنین، در تماس با پوست باعث سوختگی می شود. محصول آمونیاک در دو گرید آمونیاک صنعتی و آمونیاک آزمایشگاهی با نقطه جوش ۴/۳۳- درجه سانتی گراد و نقطه ذوب ۷/۷۷- درجه سانتی گراد در مراکز فروش موجود است.
آمونیاک با CAS Number به شماره ۷-۴۱-۷۶۶۴ یافت می شود.
خرید آمونیاک با بهترین قیمت:
برای خرید آمونیاک همین الان با شماره ما تماس بگیرید تا قیمت در هر بسته بندی چه یک لیتری چه مقادیر تناژ را به روز خدمت شما ارائه بدیم
احتمالا قبل از هر چیزی اولین سوال شما این باشد که آمونیاک را از کجا تهیه کنیم که جوابش ماییم 🙂
ما تمام تلاشمون رو میکنیم که به ” سوال آمونیاک را از کجا تهیه کنیم ” بهترین قیمت آمونیاک رو بدیم چه درمقدار صنعتی چه برای آمونیاک خانگی و آژمایشگاهی
شرکت بیسموت، یکی از بهترین فروشگاه های آنلاین در حوزه خرید و فروش مواد شیمیایی به ویژه خرید آمونیاک می باشد. شما عزیزان می توانید برای دریافت این محصول با کیفیت و مناسب، با کارشناسان و متخصصان مجموعه بیسموت ارتباط حاصل فرمایید.
قیمت آمونیاک :
جهت آگاهی سریع از قیمت آمونیاک می توانید در صفحه اول سایت مجموعه بیسموت درخواست خود را ثبت نمایید تا کارشناسان ما در اسرع وقت با شما تماس حاصل نمایند و قیمت ها و انواع کیفیت ها را در اختیار شما قرار دهند.
مشخصات فیزیکی و شیمیایی آمونیاک :
از ویژگی های شیمیایی ترکیب آمونیاک می توان به خصلت بازی آن اشاره نمود که طبق نظریه های اسید و باز برونستد – لوری و لوییس با توجه به ساختار آن که از یک اتم نیتروژن و سه اتم هیدروژن به همراه یک جفت الکترون ناپیوندی روی نیتروژن آن تشکیل می شود، یک ترکیب بازی حساب می باشد.
مولکول قطبی آمونیاک که ساختار هرم مثلثی دارد، محلول آبی با pH بیشتر از ۷ و اسیدیته (۱) ۶/۱۱ می باشد که بر بازی بودن آن (pH نرمال) تاکیید می کند. همچنین، در واکنش زیر می توان این ویژگی NH3 را به خوبی مشاهده کرد:
NH3 (aq) + H2O (l) → NH4+ (aq) + OH– (aq)
11 موارد مصرف و کاربرد :
آمونیاک یک ماده شیمیایی خطرناک است که به صورت مایع و گاز بوی قوی ایجاد می کند و مورد استفاده قرار می گیرد. از موارد مهم مورد استفاده آمونیاک می توان به موارد زیر اشاره کرد:
- تولید مواد دارویی
- کارخانجات یخ سازی
- استفاده در صنایع شیمیایی و نفت
- تولید اسید نیتریک و بسیاری از ترکیبات نیتروژنه
- استفاده در تکنولوژی انتقال گاز، حفاری و استخراج فلزات مختلف
- تولید کودهای شیمیایی ازته، اکریلونیتریل، الیاف سنتزی نیترو پارافین و نیترو سلولز
- تولید کودهای شیمیایی ازت دار کشاورزی اعم از آمونیوم سولفات، آمونیوم نیترات، آمونیوم فسفات، و اوره
این ها در حالی است که در حدود ۸۰ درصد از تولید جهانی آمونیاک به منظور تهیه کود های شیمیایی و به ویژه نیتروژنه صورت می گیرد. و باقی ماده تولیدی در بخش های صنعتی و دیگر فناوری ها به کار گرفته می شوند.
به عبارت دقیق تر، گیاه آمونیاک در بسیاری از صنایع مورد استفاده قرار می گیرد؛ به ویژه در مناطقی که برای تمیز کردن یا کود دهی محصولات مورد نیاز است. در زیر صنایعی که بیشتر از NH3 در آن ها استفاده می شود، طبقه بندی شده اند:
-
صنایع نفت
در مواردی، از آمونیاک در خنثی سازی ترکیبات اسیدی موجود در روغن خام و محافظت از تجهیزات در برابر خورندگی استفاده می کنند.
-
صنعت چرم
صنعت چرم از دیگر صنایع است که از آمونیاک، به عنوان ماده ترمیم کننده و در مصارف دیگر جهت پیشگیری از لک و کپک در مشروبات برنزه کننده استفاده می کند. این ماده در مواردی از چرم و پوست خزدار در انبار محافظت می کند.
-
صنایع کشاورزی
همان طور که در بالا اشاره شد، تقریبا ۸۰ درصد کل آمونیاک تولید شده در جهان در صنایع کشاورزی مورد استفاده قرار می گیرد. این ماده شیمیایی به عنوان یک منبع بسیار با ارزش نیتروژن شناخته می شود که برای رشد گیاهان لازم است.
با توجه به اینکه گیاهان با یکدیگر در رشد متفاوت هستند، اما به طور معمول در هر هکتار زمین مقدار ۲۰۰ پوند (معادل ۷۲/۹۰ کیلوگرم) از این ماده برای مدت یک فصل استفاده می شود. موارد مشترکی که می توان کاربر بیشتر آمونیاک در تجارت کشاورزی را در آن یافت، عبارتند از:
-
- خوراک دام: این ماده و اوره به عنوان منبع پروتئین برای تغذیه چارپایان اهلی مانند گاو، گوسفند و بز استفاده می شود.
- کود: کود مایع از آمونیاک، اوره، آمونیوم فسفات، نیترات آمونیوم، آمونیاک آبزی، آمونیوم سولفات، نمک های آمونیوم و نیترات.
- محافظت از گیاهان: از NH3 برای حفاظت و نگهداری از میوه ها استفاده می شود؛ به عنوان مثال جهت جلوگیری از زدن قارچ بر روی میوه های خاص، ذخیره ذرت با رطوبت بالا، و به عنوان ماده ضد برگ های هرز روی درختان به کار گرفته می شود.
-
عملیات پخت فلزات
عملیات پخت فلزات از برنامه های کاربری است که در آن از اتمسفر های محافظ استفاده می شود به طوری که ابتدا، آمونیاک به عنوان نیترید، کربن ترانزیت، باز پخت، ذوب کردن، دفع هیدرید سدیم و جوشکاری هیدروژن جدا می شود.
-
صنایع لاستیک و فیبر
یکی از کاربرد های دیگر آمونیاک در صنعت لاستیک دیده می شود. از این ماده شیمیایی در تثبیت لاتکس طبیعی و مصنوعی به منظور جلوگیری از پیری زودرس لاستیک ها و تایرها استفاده می شود.
-
صنایع کاغذ و خمیر آن
از آمونیاک مایع یا گاز برای خمیر چوب و به عنوان ماده پراکنده کننده پروتئین شیر (Casein) در پوشش های کاغذ استفاده می شود. همچنین در تهیه آمونیوم هیدروژن سولفید نقش دارد.
-
صنایع معدن کاری و متالوژی
از NH3 در استخراج فلزاتی مانند مس، مولیبدن، روی و نیکل از سنگ معدن آن ها استفاده می شود.
-
صنایع داروسازی و پاک کنندگی
از آمونیاک برای ساخت سولفونامید و انواع ویتامین های گروه ب در داروسازی استفاده می شود. از طرف دیگر، میتوان با کاهش غلظت آن توسط مخلوط شدن با آب، از آن به عنوان پاک کننده در مصارف خانگی استفاده برد که به «محلول آمونیاک خانگی» شناخته می شود.
-
صنایع تولید مواد شیمیایی و مواد منفجره
از این ماده برای تولید مواد شیمیایی مانند نیتریک اسید (ماده شیمیایی مورد استفاده در تولید مواد منفجره مانند آمونیوم نیترات و TNT)، نیتروگلیسیرین، سدیم هیدروژن کربنات، سدیم کربنات، هیدروژن سیانید و هیدرازین استفاده می شود و در سوخت و مشتقات سوختی به کار برده می شود.
-
صنایع غذایی، نوشیدنی ها، پتروشیمیایی و صنایع نگهدارنده سرما
NH3 به عنوان یک سرد کننده (صنایع آمونیاک مبرد) کاربرد گسترده ای در سیستم های صنعتی تبرید دارد. به علاوه، این ماده به عنوان منبع نیتروژن لازمه مخمر و میکرو ارگانیسم ها استفاده می شود.
-
سیستم های کنترل انتشار در دود کش یا محوطه بسته (سیستم کاتالیست کاهنده)
آمونیاک جهت خنثی کردن اکسید های گوگرد از احتراق و سوخت های گوگرد دار، در سیستم های کنترل انتشار گاز هایی خاص استفاده می شود. روش فوق الذکر، به عنوان فرایندی برای کنترل NOx در هر دو حالت کاتالیزوری و غیر کاتالیزوری انجام می گیرد؛ همچنین به منظور افزایش کارایی رسوبگر های الکترواستاتیک برای کنترل ذرات به کار برده می شود.
روش های تولید آمونیاک :
آمونیاک با توجه به کاربردهای گستره آن در دهه اول قرن بیستم، به عنوان ماده مورد نیاز برای تولید کود های نیتروژن دار، از اهمیت بیشتری برخوردار شد و تولید بهینه آن در اولویت های اول قرار گرفت.
فرایند تولید :
روش های متفاوتی برای انجام این فرایند وجود دارند که به دلایلی مانند مشکلات عملیاتی یا هزینه بالا قابل اجرا نبوده اند. چهار روش اصولی تولید این ماده به شرح زیر می باشند که روش آخر به سبب عملی و به صرفه بودن از لحاظ امکان تولید ماده در مقیاس بزرگ صنعتی، در مراکز امروزه انجام می پذیرد:
-
- تقطیر زغال سنگ
- سنتز مستقیم
- تهیه سینامالدئید و سیانوزها
- تولید به روش هابر
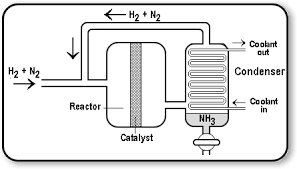
روش هابر (Haber Process) :
روش هابر توسط فریتس هابر، یکی از شیمیدانان آلمانی برنده جایزه نوبل، در سال ۱۹۰۵ ابداع شد. در آن زمان، هابر در دمای بالای ۵۰۰ درجه سانتی گراد و فشار زیاد ۱۵۰ تا ۲۰۰ اتمسفر با استفاده از یک کاتالیست آهنی و دو گاز تقریبا غیرفعال، این ماده ی بی رنگ را تولید کند. این فعالیت با همکاری هابر و بوش در سال ۱۹۱۳ به سنتز این ماده شیمیایی منجر شد.
امروزه نیز آمونیاک در فرایند هابر به عرصه تولید می رسد. این روند با سنتز کاتالیستی آمونیاک از گازهای هیدروژن(H2) و نیتروژن(N2) همراه است به صورتی که این دو گاز در حضور یک کاتالیزگر آهن با یکدیگر واکنش می دهند. هیدروژن در ادامه با واکنش گازهای طبیعی و بخار در دماهای بالا تشکیل می شود در حالی که نیتروژن از هوا تامین می شود.
گاز های دیگر مانند آب و کربن دی اکسید از جریان گاز خارج می شوند. سپس هیدروژن و نیتروژن در دمای بالا و فشار زیاد بر روی کاتالیزگر مذکور منتقل می شوند و آمونیاک را به وجود می آورند. در بعضی روند ها، واکنش در دمای ۵۰۰ درجه سانتی گراد و فشار ۲۰۰ اتمسفر رخ می دهد و در هر بار عبور گازها مقدار ۱۰ الی ۱۸ درصد از NH3 مورد نظر تشکیل می شود.
به منظور حل مشکل مقدار کم تولید این ماده، جریان گازهای برگشتی در یک چرخه مجددا به راکتور واکنش باز می گردند که سبب می شود تولید آمونیاک به ۹۷ درصد ارتقا پیدا کند.
مراحل فرایند تولید آمونیاک :
امروزه تولید آمونیاک در چند مرحله اصلی انجام می پذیرد که به شرح ذیل می باشد:
سگاز طبیعی (Removing Sulfur Compounds)
در واحد اول، مواد آلاینده گوگردی و ترکیبات مانند آن از گاز طبیعی تصفیه و سپس جداسازی می گردند که توسط کاتالیزور مخصوص روی اکسید صورت می پذیرد.
H2 + RSH → RH + H2S(g تصفیه
H2S + ZnO → ZnS + H2O جداسازی
دوباره شکل گیری کاتالیستی بخار (Catalyst Steam Reforming)
در واحد دوم، گاز فرایند حاصل از واحد اول به گاز سنتز که مخلوطی از هیدروژن، نیتروژن، آب و کربن دی اکسید است، تبدیل می شود که از طریق عبور گاز از کوره های ویژه در حضور کاتالیست انجام می شود.
CH4 + H2O → CO + 3H2
تغییر کربن مونوکسید به کربن دی اکسید و هیدروژن
در واحد سوم، ترکیبات منواکسید موجود در گاز سنتز به کربن دی اکسید و مقدار بیشتری از هیدروژن تبدیل می شوند که از ترکیبات اوره می باشد.
CO + H2O → CO2 + H2
جذب و حذف گاز کربن دی اکسید
در واحد چهارم، کربن دی اکسید از گاز سنتز جدا شده و به بخش اوره ارسال می گردد.
CO + 3H2 → CH4 + H2O
CO2 + 4H2 → CH4 + 2H2O
چرخه سنتز آمونیاک (Ammonia Synthesis Loop)
در واحد پنجم، گاز سنتز حاصل از واحد های قبل شامل هیدروژن و ازت در راکتور مخصوص تبدیل به آمونیاک مایع بی آب می شوند.
3H2 + N2 → 2NH3
تبرید و ذخیره سازی آمونیاک
در بخش آخر، آمونیاک با دمای ۳۳- درجه سانتی گراد به صورت مایع در مخزن مخصوص ذخیره سازی برودتی (با ظرفیت ۲۰ هزار تن) ذخیره می شود. سپس توسط سیستم پمپاز به اسکله صادراتی جهت بارگیری کشتی ارسال می گردد.
ملاحظات محیط زیستی :
با توجه به انتشار گازهای گلخانه ای در سراسر کره زمین و دفع زباله، دانشمندان و محققان در تلاش اند تا برای کاهش آلودگی های منتشر شده در سرتاسر جهان به دلیل تولید آمونیاک، ملاحظات اساسی بسیاری انجام دهند. به طور کلی، آمونیاک برای آب زیان و محیط زیست بسیار سمی می باشد و از طرف دیگر، رها شدن مقدار بالای آن در هوا موجب آلودگی هوا می شود.
در موارد دیگر، اگرچه آمونیاک به خودی خود تجزیه پذیر نمی باشد اما اگر در دما و فشار مشخصی قرار گیرد، با مواد شیمیایی گسترده ای واکنش می دهد و به سرعت تجزیه می گردد.
مکانیسم عمل در هنگام تماس :
NH3 بلافاصله پس از تماس با پوست، چشم، حفره دهان، دستگاه تنفسی (در صورت استنشاق) و به ویژه سطوح مخاطی، با رطوبت موجود در این نواحی شروع به تعامل می کند و آمونیوم هیدروکسید را که بسیار سوز آور است، به وجود می آورد. آمونیوم هیدروکسید در این بخش ها با اختلال در نکروز بافت ها از طریق اختلال در لیپید های غشای سلولی (ساپونی سازی) همراه شده که منجر به تخریب سلولی می شود. با تجزیه پروتئین های سلولی، آب استخراج می شود که موجب ایجاد یک واکنش التهابی می شود و آسیب بیشتر می گردد.
از آنجایی که آمونیاک در دسته مواد شیمیایی خورنده و حساس کننده قرار می گیرد، در هنگام تماس با چشم و پوست، بلعیده و خورده شدن، و تنفس باید به هشدارهای حفاظتی به طور دقیق عمل کرد.
بسته بندی :
این ماده ی بی رنگ به دو صورت صنعتی و آزمایشگاهی به فروش می رسد. آمونیاک صنعتی در گالن های ۲۰ لیتری یا تانکرهای ۲۲ تنی موجود است. در حالی که NH3 آزمایشگاهی در گالن های ۵/۲ لیتری در دسترس قرار می گیرد.
منابع اصلی :
https://www.analyticaltechnology.com/analyticaltechnology/gas-water-monitors/blog.aspx?ID=1144&Title=Industries
https://www.health.ny.gov/environmental/emergency/chemical_terrorism/ammonia_tech.htm
https://nzic.org.nz/app/uploads/2017/10/1A.pdf
15 دیدگاه دربارهٔ «11 موارد مصرف و کاربرد و خرید آمونیاک با بهترین قیمت;
سلام
یک ماده می خواهم که درون اب حل شود ودر گرما از اب جدا شود بدون اینکه خاصیت خود را ازدست بدهد مانند امونیاک ولی بی خطر باشد
یه ماده شیمیایی بی خطر می خواهم که درون اب حل بشه و در اثر گرما از اب جدا شود
مانند امونیاک
سلام ایا امونیاک مایع بعد از ریختن بر روی زمین وگذشت ۷ سال از ان، میتواند بر اثر برخورد با پای انسان باعث ایجاد نروپاتی و درد بر روی پا شود؟ آیا آمونیاک مایع بعد از گذشت ۷ سال از خشک شدن آن بر روی زمین از بین میرود و تاثیرش محو میشود؟
سلام و درود
با شما در تلگرام صحبت کردیم کامل و توضیحات کامل رو خدمتتون عرض کردم
لطفا سریعا برای این موارد به دکتر مراجعه کنید.
ایمنی در کار با مواد شیمیایی بشدت مهم میباشد.
با عرض سلام
شما محصول آمونیک خشک یا به عبارتی آمونیاک بی آب دارین اگه دارین با ایمیل من تماس بگیرید برای صادرات میخواهم.
سلام
حتما از طریق ایمیل با شما در تماس خواهیم بود
سلام
قیمت محلول آمونیاک آزمایشگاهی چنده؟
سلام برای دریافت قیمت لطف کنید با شماره شرکت تماس بگیرید
با سلام از کجا میشه محلول آمونیاک را خریداری کرد غیر سایت ها و فروشگاه های مواد شیمیایی؟
سلام
میتونید به ناصر خسرو مراجعه کنید
باسلام ی سوال دلیل استفاده از گرم کننده و سردکننده چیه؟؟؟
سلام
عذرخواهم آمونیاک مایع مگر باتحت فشار قراردادن گاز آمونیاک تولید نمی شود؟ اگر اینطور است پس چطور داخل گالن نگهداری میشود؟
ممنون از شما
نقطه جوش بالای این ماده در مقایسه با همنوع های سنگینترش ، نشان از وجود پیوند هیدروژنی قوی در این ترکیب است ، وجود پیوند هیدروژنی قوی موجب بالا بودن گرمای تبخیر آن نیز شده است. این عوامل باعث می شوند تا بتوان از این ترکیب علی رغم نقطه جوش پایینش در دمای اتاق به راحتی به صورت مایع استفاده کرد.
قیمت محلول آمونیاک خانگی چنده؟
سلام
اول: باید بگم که آمونیاک خانگی و امونیاک معمولی تفاوتی ندارند و این یک ایده عمومی است که این دو متفاوتند
دوم: قیمت آمونیاک (به صورت حدودی) 30 هزار تومان هست برای هر لیتر
سوم: خیلی خوشحالم میشم بازم اگه سوالی بود کمکتون کنم