از لحاظ تاریخی ، الکل ها در ارتباط با فعالیت های اجتماعی اعم از آیین های مذهبی و غیر مذهبی ، به عنوان یک ماده غذایی و همچنین به عنوان یک ماده دارویی مورد استفاده قرار می گرفت است. الکل ها زمانی برای اهداف درمانی استفاده می شدند ، اما به دلیل توانایی آن ها در ایجاد مسمومیت ، دیگر به عنوان یک ماده دارویی توصیه نشد. قابلیت انحلال الکل ها در آب باعث می شود که به سرعت در بدن جذب شده و ایجاد مسمومیت کند
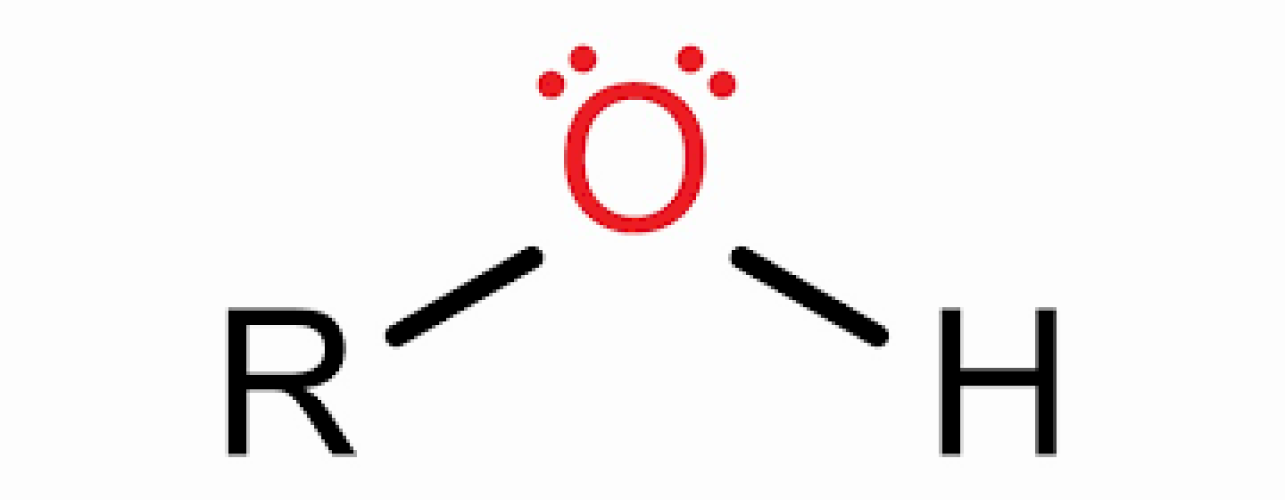
الکل ها یکی از دسته های ترکیبات آلی است ، که با یک یا چند گروه هیدروکسیل (-OH)متصل به یک اتم کربن از یک گروه آلکیل (زنجیره هیدروکربن)تشکیل شده است. الکلها ممکن است به عنوان مشتقات آلی آب(H2O) در نظر گرفته شوند که در آن یکی از اتمهای هیدروژن توسط گروه آلکیل جایگزین می شود ، که معمولاً توسط R در ساختارهای آلی نشان داده می شود. به عنوان مثال ، در گروه اتانول (یا اتیل الکل) آلکیل گروه اتیل ―CH2CH3 است.
انواع الکل ها از لحاظ ساختار
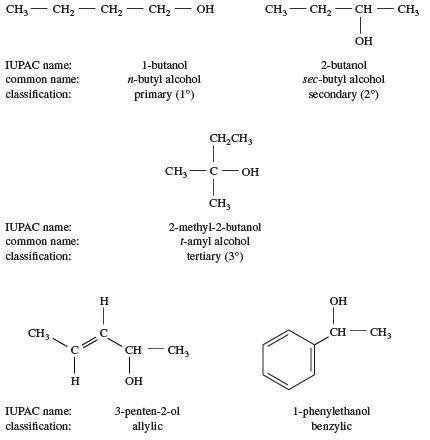
یکی از راه های طبقه بندی الکل ها بر اساس اتم نوع کربن متصلبه گروه هیدروکسیل می باشد. اگر این کربن ، کربن نوع اول باشد (تنها به یک اتم کربن دیگر متصل باشد.) ، ترکیب یک الکل نوع اول است. یک الکل نوع دوم دارای گروه هیدروکسیل متصل به کربن نوع دوم است که به دو اتم کربن دیگر متصل شده است. به طور مشابه ، در الکل نوع سوم گروه هیدروکسیل متصل به کربن نوع سوم می باشد ، که به سه کربن دیگر پیوند می خورده است. اگر گروه هیدروکسیل به ترتیب به یک اتم کربن آلیلیک (در مجاورت یک پیوند دوگانهC = C) یا یک اتم کربن بنزلیک (در کنار یک حلقه بنزن) متصل شود ، الکل های نوع آللی یا بنزیلی به وجود می آید.
خواص فیزیکی الکل ها
اکثر الکلهای رایج مایعاتی بی رنگ در دمای اتاق هستند. متیل الکل ، اتیل الکل و ایزوپروپیل الکل مایعاتی پر کاربرد و دارای بوی میوه ای هستند. الکلهای بالاتر آن هایی که حاوی 4 تا 10 اتم کربن هستند ،تا حدودی چسبناک یا روغنی می باشند و بوی میوه ای سنگین تری دارند. برخی از الکل های بسیار شاخه دار و بسیاری از الکل های حاوی بیش از 12 اتم کربن در دمای اتاق به صورت جامد دیده شده اند.
مقایسه نقطه جوش الکل ها
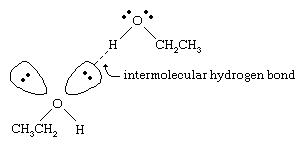
نقاط جوش الکل ها بسیار بیشتر از آلکان ها با وزن مولکولی مشابه است. به عنوان مثال ، اتانول ، با وزن مولکولی (MW) 46 ، دارای نقطه جوش 78 درجه سانتیگراد (173 درجه فارنهایت) است ، در حالی که پروپان (MW 44) دارای نقطه جوش 42 درجه سانتیگراد (44- درجه فارنهایت) است. چنین تفاوت بزرگی در نقاط جوش نشان می دهد که مولکولهای اتانول بسیار قوی تر از مولکولهای پروپان به یکدیگر جذب می شوند. بیشتر این تفاوت ناشی از توانایی اتانول و سایر الکلها در ایجاد پیوندهای هیدروژنی بین مولکولی است.
انحلال الکل ها و پیوند هیدروژنی
اتم اکسیژن پیوند O-H به شدت الکترونگاتیو است ، در نتیجه در یک الکل تراکم الکترون را از اتم هیدروژن دور می کند. این هیدروژن قطبی ، که دارای بار مثبت جزئی است ، می تواند با یک جفت الکترون غیر پیوندی در اتم اکسیژن دیگر پیوندی هیدروژنی تشکیل دهد. پیوندهای هیدروژنی ، با استحکام حدود 5 کیلو کالری (21 کیلوژول) در هر مول ، بسیار ضعیف تر از پیوند های کووالانسی معمولی هستند ، با انرژی پیوند حدود 70 تا 110 کیلو کالری در هر مول. (مقدار انرژی در هر مول که برای شکستن پیوند معین مورد نیاز است ، انرژی پیوند آن نامیده می شود.)
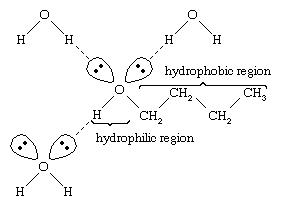
آب و الکل دارای خواص مشابهی هستند زیرا مولکولهای آب حاوی گروههای هیدروکسیلی هستند که می توانند پیوندهای هیدروژنی را با سایر مولکولهای آب و با مولکولهای الکل تشکیل دهند و به همین ترتیب مولکولهای الکل می توانند با سایر مولکولهای الکل و همچنین با آب پیوندهای هیدروژنی برقرارکنند. از آنجا که الکلها پیوندهای هیدروژنی را با آب تشکیل می دهند ، تمایل دارند که در آب نسبتاً محلول ظاهر شوند. گروه هیدروکسیل به عنوان یک گروه آبدوست شناخته می شود ، و حلالیت یک الکل در آب را تقویت می کند. متانول ، اتانول ، الکل-پروپیلیل الکل ، ایزوپروپیل الکل و تی بوتیل الکل همه محلول در آب هستند.
درباره حلال های شیمیایی بیشتر بدانید
الکلهای دارای وزن مولکولی بالاتر ، کمتر در آب حل می شوند، زیرا قسمت هیدروکربنی مولکول ، که آبگریز است ، با افزایش وزن مولکولی بزرگتر می شود. از آنجا که الکل ها به شدت قطبی هستند ، حلال های بهتری نسبت به هیدروکربن ها برای ترکیبات یونی و سایر مواد قطبی به حساب می آیند.
نامگذاری الکل ها
روش قدیمی:
نامهای رایج برای الکل ها معمولاً با نام گروه آلکیل مربوطه و به دنبال آن کلمه “الکل” شروع می شود. نمونه هایی از آن متیل الکل، اتیل الکل و تری بوتیل الکل است. اگر گروه هیدروکسیل به اولین اتم کربن در زنجیره پروپان متصل شود ، الکل پروپیل به نام n-propyl الکل خوانده می شود. اگر گروه هیدروکسیل به اتم کربن دوم در زنجیره پروپان پیوند یافته باشد، ایزوپروپیل الکل خوانده می شود.
روش IUPAC:
طبق اتحادیه بین المللی شیمی (IUPAC) ، الکلها با تغییر انتهای نام آلکان شاخه اصلی به -ol نامگذاری می شوند. در اینجا چند قانون اساسی IUPAC برای نامگذاری الکلها آورده شده است:
- طولانی ترین زنجیره مداوم (LCC) اتم های کربن حاوی گروه OH به عنوان شاخه اصلی انتخاب شده – یک آلکان با همان تعداد اتم کربن این زنجیره از نزدیکترین گروه OH شماره گذاری می شود.
- عددی که موقعیت گروه OH را نشان می دهد با نام هیدروکربن شاخه اصلی پیشوند داده می شود. و انتهای -e آلکان والدین با پسوند -ol جایگزین می شود. در الکلهای حلقوی ، اتم کربن که دارای گروه OH است ، C1 تعیین می شود ، اما 1 به این نام استفاده نمی شود.) مواد جایگزین مانند آلکان ها نامگذاری و شماره گذاری می شوند).
- اگر بیش از یک گروه OH در همان مولکول (الکلهای پلی هیدروکسی) ظاهر شود ، از پسوندهایی مانند -diol و -triol استفاده می شود. در این موارد ، انتهای -e آلکان شاخه اصلی حفظ می شود.
روش های تهیه alcohols
منابع طبیعی الکل ها:
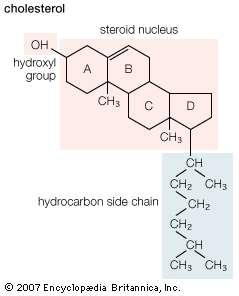
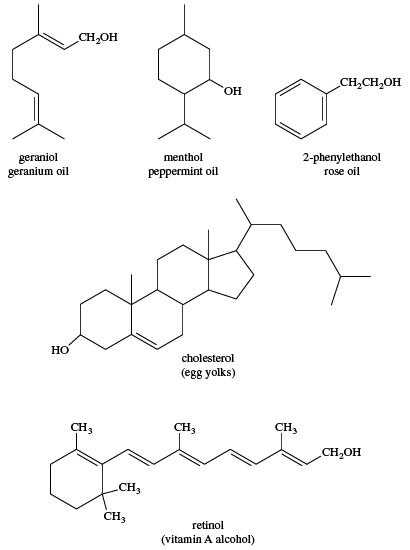
الکلهای پیچیده تر اغلب با فرآیند تقطیر بخار از روغنهای فرار گیاهان جدا می شوند. مواد گیاهی در آب جوشانده می شوند و روغنهای فرار توسط بخار ، متراکم شده و از آب جدا می شوند. موادی مانند کلسترول ، که در بیشتر بافتهای حیوانات (و به وفور در زرده تخم مرغ) وجود دارد ، و رتینول ویتامین A الکل ، که از روغنهای کبد ماهی استخراج می شود ، نمونه هایی از منابع طبیعی الکل هستند.
ساختار برخی از منابع الکلی که به طور طبیعی وجود دارند: ژرانیول (روغن شمعدانی) ، منتول (روغن نعناع) ، 2-فنیل اتیانول (روغن گل سرخ) ، کلسترول (زرده تخم مرغ) ، رتینول ویتامین A
الکل های زنجیره ای طولانی را می توان از طریق چربی ها و موم ها با استفاده از هیدرولیز در پایه به نام ساپونی سازی و به دنبال آن کاهش ، بدست آورد.
منابع غیر طبیعی الکل ها:
-
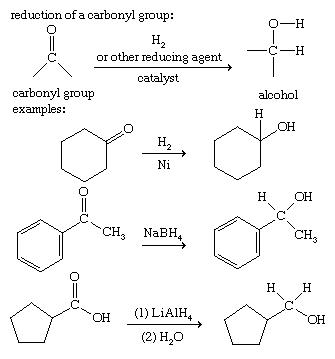
کاهش ترکیبات کربونیل:
افزودن دو اتم هیدروژن به یک گروه کربونیل الکل تولید می کند. این یک نمونه از کاهش است. کتونها ، آلدهیدها و اسیدهای کربوکسیلیک با افزودن کاتالیزور هیدروژن گازی (H2) یا طیف گسترده ای از داروهای کاهنده خاص ، مانند هیدرید لیتیم آلومینیوم (LiAlH4) و سدیم بوروهیدرید (NaBH4)کاهش می یابد.
-
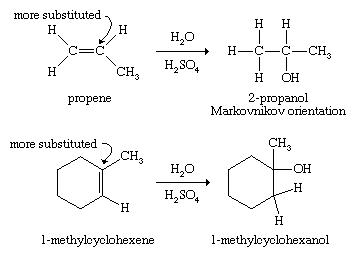
هیدراسیون آلکن ها:
افزودن آب (هیدراسیون) در پیوند مضاعف یک آلکن باعث ایجاد الکل می شود. آلکن ها به عنوان محصول پتروشیمی زغال سنگ و پالایش نفت موجود هستند و درشرایط کاتالیزوری می توانند از افزودن آب به پیوند دوتایی الکل تولید کنند.
-
جابجایی هالیدها:
یون هیدروکسید می تواند یون هالید را از یک آلکیل هالید نوع اول ، جابجا کند و یک الکل بدهد. این واکنش جابجایی اغلب برای سنتز الکل ها مورد استفاده قرار نمی گیرد، زیرا آلکیل هالید ها بیشتر از الکل ها تولید می شوند .
-
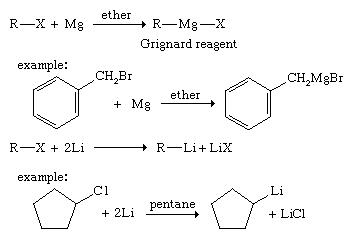
با استفاده از معرفهای Grignard و organolithium
معرفهای Grignard و organolithium ابزاری قدرتمند برای سنتزهای آلی هستند و رایج ترین محصولات واکنش آن ها الکل ها هستند. معرف Grignard با واکنش یک آلکیل هالید (RX ، که در آن X یک هالوژن است) با فلز منیزیم (Mg) در محلول اتر تشکیل می شود. این محصول با عنوان R ― Mg ― X نوشته شده است) ، اگرچه پ پ معرف های Grignard پیچیده تر از آنچه این ساختار ساده نشان می دهد ، هستند. معرفهای ارگانولیتیوم به همان روش معرف های Grignard شکل می گیرند ، به جز اینکه دیگر حلال اتر لازم نیست. اکثر واکنش های معرف های ارگانولیتیوم مشابه واکنشهای گرینارد هستند. با این حال ، تفاوت های مهمی وجود دارد.
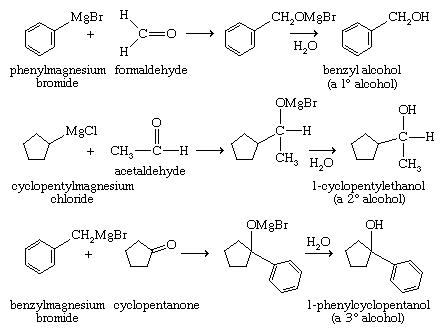
معرفهای Grignard به ترکیبات کربونیل (یعنی ترکیبات حاوی C = O) اضافه می شوند تا آلکوکسیدهای منیزیم (ROMgX) ) تولید کنند که در نتیجه به الکل ها هیدرولیز شوند. طیف گسترده ای از الکل ها را می توان با افزودنی های Grignard سنتز کرد. معرف Grignard به فرمالدئید اضافه می شود تا یک الکل نوع اول تولید می شود ، با اضافه کردن این معرف به یک آلدهید می توان یک الکل نوع دوم و با اضافه کردن به یک کتون ، یک الکل نوع سوم می توان تولید کرد.
معرفهای Grignard دو بار به استرها اضافه می شوند تا الکل تولید شود (پس از هیدرولیز). این روش برای ساختن الکلهای نوع دوم با دو گروه آلکیل است. آنها همچنین به اپوکسیدها اضافه می شوند ، و الکل های اصلی را به همراه می آورند که در آن دو اتم کربن اضافی به زنجیره معرف Grignard اضافه شده است.
کاربرد alcohols :
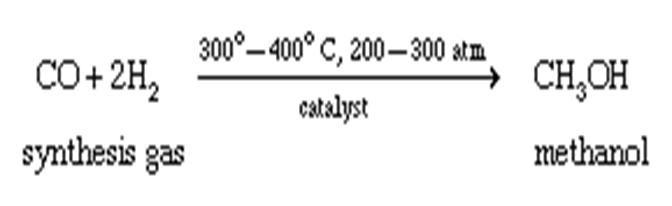
الکل ها یکی از رایج ترین ترکیبات آلی هستند.از الکل ها به عنوان شیرین کننده ها و در ساخت عطرها از واسطه های ارزشمندی در سنتز ترکیبات دیگر استفاده می شود و از جمله پرکاربرد ترین مواد شیمیایی آلی در صنعت هستند. شاید این دو الکل اتانول و متانول (یا متیل الکل) معروف ترین الکل ها باشند. اتانول در مواد بهداشتی ، دارویی و سوختی استفاده می شود و برای استریل کردن تجهیزات بیمارستان از آن استفاده می شود. علاوه بر این ،. اتر بیهوشی نیز از اتانول ساخته امی شود. از متانول به عنوان حلال ، به عنوان ماده اولیه برای تولید فرمالدهید و رزین های ویژه ، سوخت های ویژه ، ضد یخ و تمیز کردن فلزات استفاده می شود.
برخی از الکل های معروف :
-
اتانول :
اتانول ، اتیل الکل ، الکل سفید ، الکل طبی و الکل میوه نام هایی هستند که این الکل را با آن ها می شناسند. اتانول یک مایع شفاف ، بی رنگ و ماده اصلی در نوشیدنی های الکلی است. از آنجا که اتانول می تواند به آسانی در آب و سایر ترکیبات آلی حل شود ، یک ماده مهم در انواع محصولات است ، از محصولات مراقبت شخصی و زیبایی تا رنگ ها و لاک ها تا سوخت ها. از اتانول برای ضدعفونی کردن وسایل و تجهیزات آزمایشگاهی استفاده می شود.
-
متانول :
متانول (که به الکل چوب و متیل الکل نیز معروف است) بیشتر برای ایجاد سوخت ، حلال ها و ضد یخ استفاده می شود. متانول یک مایع بی رنگ ، فرار ، قابل اشتعال است و برخلاف اتانول ، برای مصرف انسان سمی است. از متانول همچنین برای تولید انواع دیگر مواد شیمیایی از جمله استیک اسید استفاده می شود.
مقادیر اندکی از متانول به طور طبیعی در بسیاری از موجودات زنده به عنوان بخشی از فرآیندهای متابولیک آن ها یافت می شود. به عنوان مثال ، متانول در بسیاری از میوه ها و سبزیجات به طور تولید می شود.
-
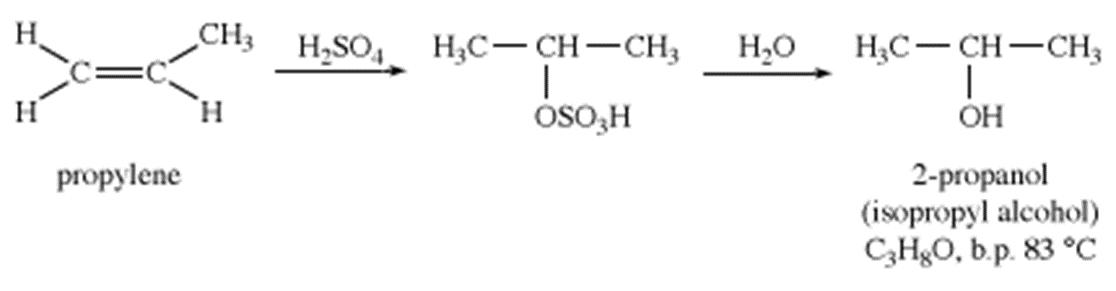
ایزوپروپیل الکل :
ایزوپروپیل الکل (2-پروپانول) توسط هیدراسیون غیر مستقیم پروپیلنساخته می شود. ایزوپروپیل الکل معمولاً به عنوان یک حلال صنعتی و به عنوان یک الکل مالش دهنده بر روی پوست مورد استفاده قرار می گیرد. اگرچه ایزوپروپیل الکل سمی تر از اتانول است ، اما اثر خشک کنندگی کمتری بر روی پوست دارد .
-
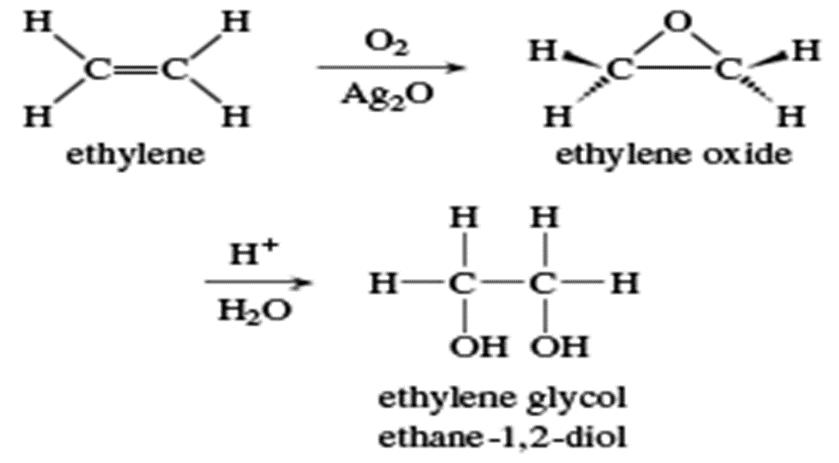
اتیلن گلیکول :
نام اتیلن گلیکول به معنای واقعی کلمه به “گلیکول ساخته شده از اتیلن” اطلاق می شود. نام سیستماتیک آن اتان-1،2-دیول است. اتیلن گلیکول معمولاً به عنوان ضد یخ خودرو و به عنوان ماده ای در مایعات هیدرولیک ، جوهر چاپی و حلال های رنگ مورد استفاده قرار می گیرد. همچنین در ساخت پلی استرها ، مواد منفجره ، رزین های آلکیدی و مومهای مصنوعی به عنوان ماده معرف استفاده می شود.
واکنش های الکل ها :
از آنجا که الکل ها به راحتی سنتز می شوند و به راحتی به ترکیبات دیگر تبدیل می شوند ، به عنوان واسطه های مهم در سنتز آلی استفاده می شوند. یک سنتز چند مرحله ای ممکن است از واکنش های شبیه Grignard برای تشکیل یک الکل با ساختار کربن مورد نظر استفاده کند ، و به دنبال آن واکنش هایی برای تبدیل گروه هیدروکسیل الکل به عملکرد مورد نظر. شایع ترین واکنش های الکل ها را می توان به عنوان اکسیداسیون ، کمبود آب ، تعویض ، استری شدن و واکنش آلکوکسیدها طبقه بندی کرد.
-
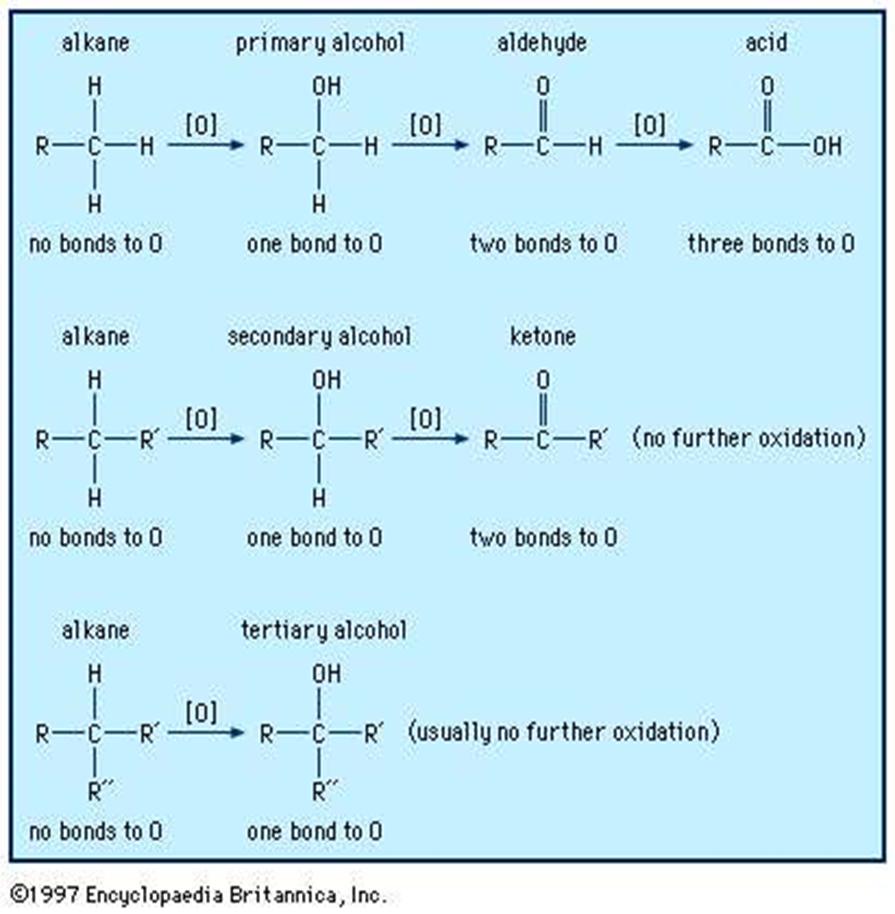
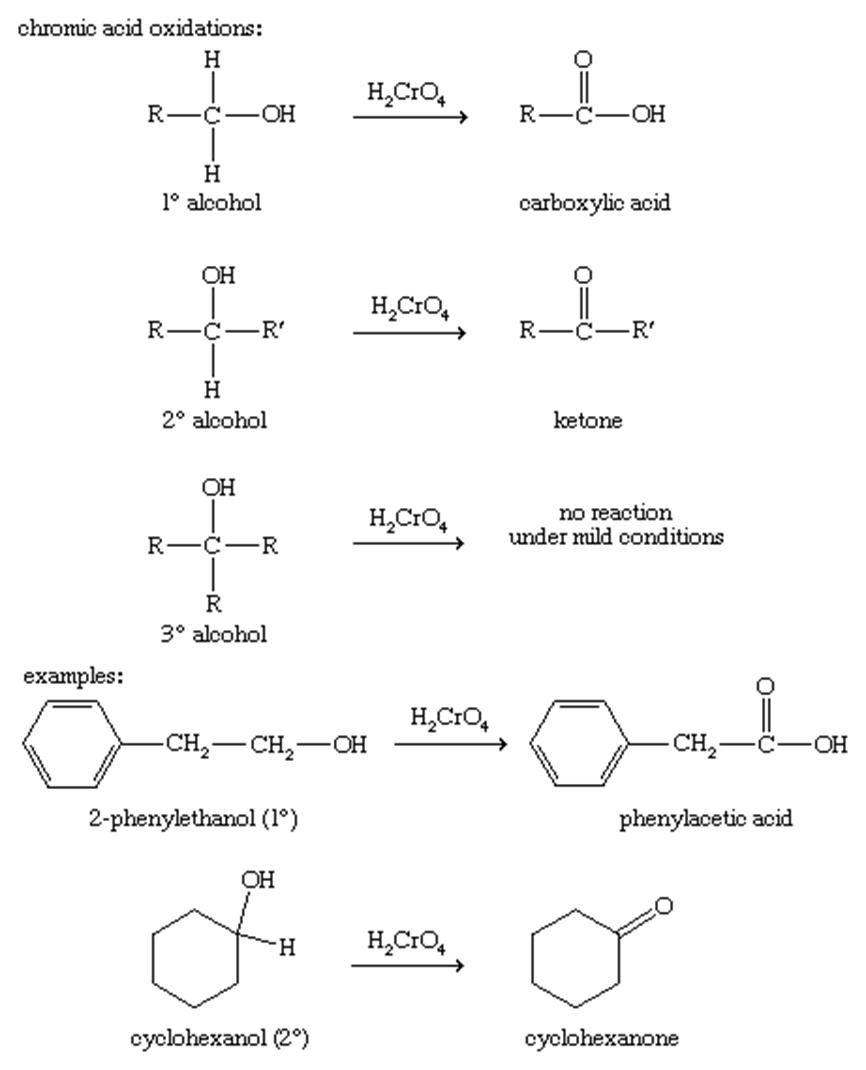
اکسیداسیون:
الکل ها برای تولید کتون ها ، آلدهیدها و اسیدهای کربوکسیلیک ممکن است اکسید شوند. به عنوان مثال ، کتون ها و آلدهیدها می توانند در واکنشهای بعدی Grignard استفاده شوند و اسیدهای کربوکسیلیک نیز برای استری سازی قابل استفاده هستند. اکسیداسیون ترکیبات آلی به طور کلی تعداد پیوندها از کربن به اکسیژن (یا یک عنصر الکترو مغناطیسی دیگر مانند هالوژن) را افزایش می دهد و ممکن است تعداد پیوندها را به هیدروژن کاهش دهد.
الکل های ثانویه به راحتی و بدون شکستن پیوندهای کربن-کربن فقط تا مرحله کتون اکسید می شوند. هیچ اکسیداسیون دیگری جز در شرایط بسیار سخت دیده نمی شود. الکل های نوع دوم به هیچ وجه بدون شکستن پیوندهای کربن کربن قابل اکسایش نیستند ، در حالی که الکل های اصلی می توانند به آلدهیدها اکسید شوند یا بیشتر به اسیدهای کربوکسیلیک اکسید شوند.
اسید کرومیک (H2CrO4 ، که با اختلاط دی کرومات سدیم ، Na2Cr2O7 ، با اسید سولفوریک ، H2SO4 تولید می شود) یک اکسید کننده موثر برای اکثر الکل ها است. این یک اکسید کننده قوی است و الکل را تا حد ممکن اکسید می کند بدون اینکه پیوندهای کربن-کربن را بشکند. اسید کرومیک الکل های اصلی را در برابر اسیدهای کربوکسیلیک اکسید می کند ، و الکل های نوع دوم را به کتون اکسید می کند. الکل های نوع سوم تحت شرایط خفیف با اسید کرومیک واکنش نمی دهند. با دمای بالاتر یا اسید غلیظ تر ، پیوندهای کربن-کربن ممکن است اکسید شوند. با این حال ، بازده حاصل از چنین اکسیداسیون های قوی معمولاً ضعیف است.
می توانید برای خرید و دریافت اطلاعات بیشتر درباره ی اسید کرومیک به مقاله ی اسید کرومیک چیست در سایت ما مراجعه کنید.
-
آب زدایی از آلکن ها
تبدیل یک الکل به یک آلکن نیاز به حذف گروه هیدروکسیل و یک اتم هیدروژن در اتم کربن همسایه دارد. از آنجا که عناصر آب برداشته می شوند ، این واکنش را آبزدایی می نامند . آبزدایی معمولاً با گرم کردن الکل در حضور یک اسید دهیدرات کننده قوی مانند اسید سولفوریک غلیظ انجام می شود.
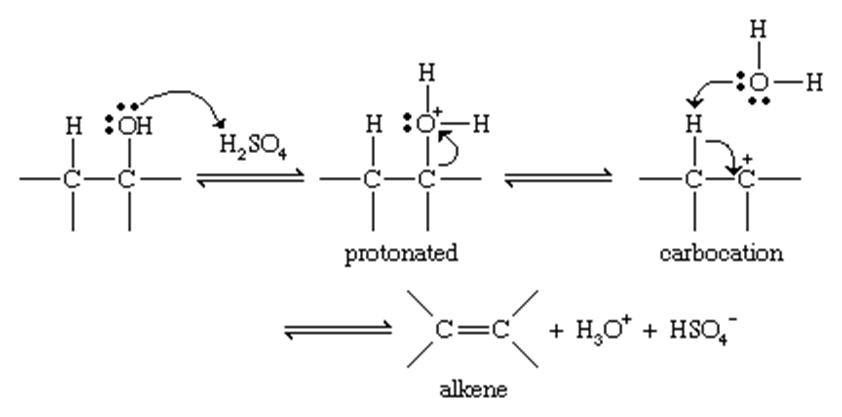
بیشتر آبزدایی از الکل توسط مکانیسم نشان داده شده در زیر انجام می شود. پروتون سازی از گروه هیدروکسیل اجازه می دهد تا آن را به عنوان یک مولکول آب ترک کند. گونه ای که باقیمانده است دارای یک اتم کربن با تنها سه پیوند و بار مثبت است و به آن کربون کاتیون می گویند. این گونه واسطه با از دست دادن یک پروتون از یک اتم کربن در مجاورت یون کربن با بار مثبت ، می تواند تثبیت شود و به آلکان بدهد.
-
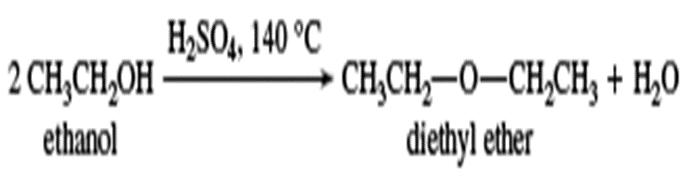
آبزدایی به اترها
تحت شرایط دقیق کنترل شده ، الکل های ساده می توانند با از دست دادن هیدروژن بین مولکولی به اتر ها تبدیل شوند. این واکنش فقط با متانول ، اتانول و سایر الکل های اولیه ساده مؤثر است ، این روش اقتصادی ترین روش برای ساخت اتیل اتر (همچنین به عنوان دی اتیل اتر شناخته می شود) ، یک حلال مهم صنعتی است.
-
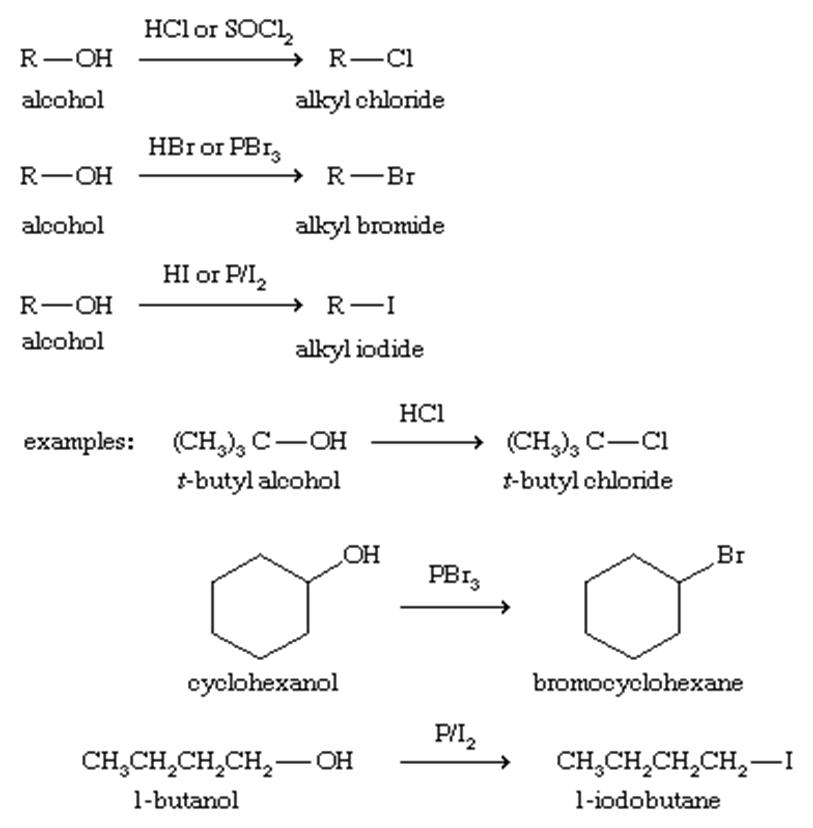
واکنش جایگزینی برای تشکیل آلکیل هالیدها:
آلکیل هالید ها اغلب از الکل ها سنتز می شوند ، در واقع جایگزینی یک اتم هالوژن با گروه هیدروکسیل صورت می گیرد. هیدروکلریک اسید ، هیدروبرومیک و هیدرویدیک معرفهای مفیدی برای این تعویض هستند و بهترین عملکرد خود را با الکل های نوع سوم دارند. تونیل کلرید (SOCl2) ، فسفر تریبرومید (PBr3) و ید مولکولی ، به ترتیب برای ساختن کلریدهای آلکیل ، برمیدها و یدیدها نیز مفید هستند.
-
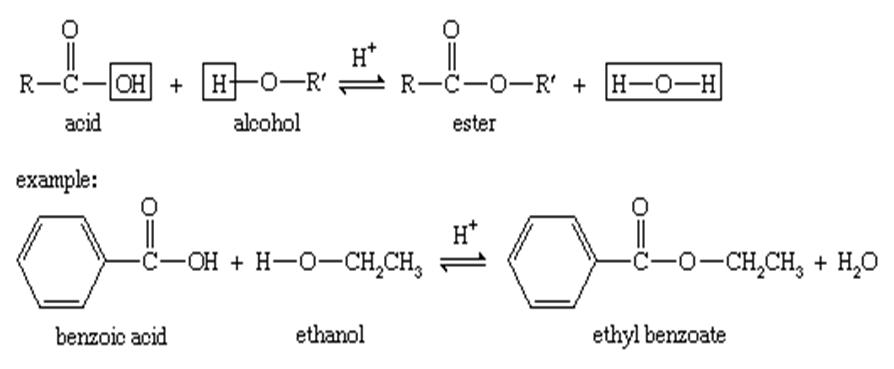
استر سازی :
الکلها می توانند با اسیدهای زیادی ترکیب شوند تا استرها را تشکیل دهند. واکنش ، به نام استری سازی فیشر ، با ترکیب یک الکل و یک اسید (با کاتالیز اسید) برای تولید استر به علاوه آب مشخص می شود.
در شرایط مناسب ، اسیدهای معدنی نیز با الکل واکنش می دهند تا استرها را تشکیل شود. برای شکل گیری این استرها می توان از طیف گسترده ای از معرف ها و شرایط خاص استفاده کرد.
خرید انواع الکل ها:
برای اطلاع از قیمت و تعرفه های انواع الکل ها می توانید به وب سایت خرید و فروش مواد شیمیایی بیسموت مراجعه کرده و از مشاوره متخصصین ما بهره مند شوید.
منبع اصلی مقاله: alcohols
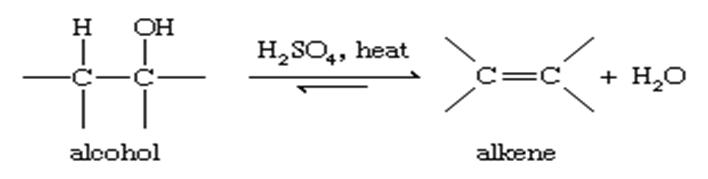






10 دیدگاه دربارهٔ «الکل ها (alcohols);
آیا الکل با چدن واکنش نشان میدهد ؟
آیا برای خرید عمده مواد شیمیایی ضمانت یا تضمینی ارائه می دهید؟
از آرامش خاطر ناشی از دانستن اینکه می توانم برای تمام نیازهای شیمیایی خود به این فروشنده اعتماد کنم، قدردانی می کنم.
سلام بهترین الکل برای چراغ الکلی مخصوص کوهنوردی چیه، که حرارت ریشتری تولید کنه؟
سلام و درود
شما میتوانید اتیل الکل 90 درصد به بالا یا ایزوپروپیل الکل استفاده کنید.
بازم اگر سؤال دیگری بود در خدمت هستم
سلام .. نتیجه واکنش الکل با هوا چی میشه
سلام و درود
الکل میتونه با اکسیژن موجود در هوا به شرط بودن انرژی فعال سازی اولیه، آتش بگیرد.
با درود فراوان
بسیار ممنون از توضیحات کامل در مورد معرفی مواد شیمیایی
همچنین تشکر ویژه ای دارم از شما که این مطالب مهم و بدرد بخور با دقت و صبر و حوصله جمع آوری کردید و در جهت ارتقا سطح دانش افراد بدون منت در اختیار همه قرار میدید.
بسیار آموزنده و دلچسب بود
حق یارتون
سلام و درود
خوشحالم که این مطلب مورد توجه شما قرار گرفته
سلام چرا عامل OH روی حلقه بنزن الک نمیسازد ؟