اترهـا (ethers)
اتر چیست ؟
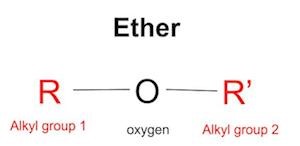
اترها دسته ای از مواد شمیایی آلی هستند و اولین بار به عنوان بیهوش کننده از آنها استفاده شده است. از نظر فنی ، اتر ترکیبی است که اتم اکسیژن به دو گروه دارای کربن ، به نام گروه های آلکیل ، از هر طرف وصل می شود ، همانطور که در اینجا نشان داده شده است. ما می توانیم از حرف “R” برای نشان دادن گروههای آلکیل در نمودار مولکول استفاده کنیم.
درجه حرارت اتر ها در مقایسه با آب و الکل ها نقطه جوش پایین تر دارند. با توجه به ساختار مولکول ، اتر بسیار قابل اشتعال است ، به همین دلیل تا حدودی به همین دلیل امروزه دیگر در پزشکی از آن استفاده نمی شود. برای جلوگیری از هرگونه واکنش شیمیایی که ممکن است باعث آتش سوزی شود ، اتر در یک بطری قهوه ای نگهداری می شود ، که اجازه نمی دهد نور خورشید با مواد شیمیایی در تعامل باشد.
بسته به نوع گروه R ، اترها خواص مختلفی دارند. یکی از رایج ترین اترها دی اتیل اتر است که همانطور که در ابتدا گفته شد به عنوان بیهوش کننده مورد استفاده قرار می گرفت. اتیل اتر در اینجا نشان داده شده است.
مشخصات فیزیکی اترها
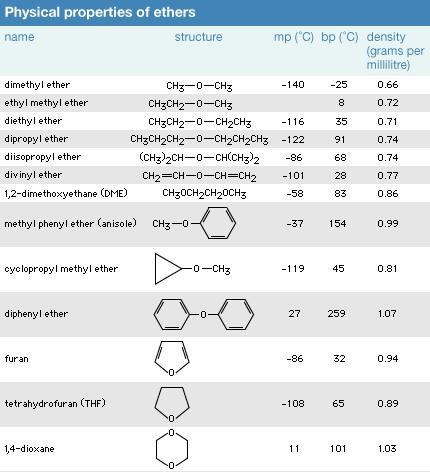
در دمای اتاق ، اترها مایعاتی بی رنگ و خوش بو هستند. اترها معمولاً چگالی کمتر ، انحلال پذیری پایین تر و نقاط جوش کمتری نسبت به الکل ها دارند. آنها نسبتاً غیرفعال هستند و در نتیجه به عنوان حلال برای چربی ها ، روغن ها ، موم ها ، عطرها ، رزین ها ، رنگ ها ، لثه ها و هیدروکربن ها مفید هستند. بخارات اترها به عنوان حشره کشها ، میتسیدها و بخارهای خاک استفاده می شود.
مشخصات ساختاری اترها
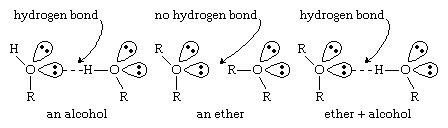
اترها فاقد گروههای هیدروکسیل هستند. بدون پیوند O-H که یک پیوند به شدت قطبی است ، مولکول های اتر نمی توانند با یکدیگر پیوند هیدروژنی برقرار کنند. با این حال ، اترها دارای جفت الکترون غیر پیوندی بر روی اتمهای اکسیژن خود هستند و می توانند پیوندهای هیدروژن را با مولکولهای دیگر (الکل ، آمین و غیره) که دارای پیوندهای O-H یا N-H هستند تشکیل دهند. توانایی ایجاد پیوندهای هیدروژن با سایر ترکیبات باعث می شود که اترها حلالهای خوبی برای طیف گسترده ای از ترکیبات آلی و تعداد بسیار زیادی از ترکیبات معدنی باشند.
از آنجا که مولکول های اتر نمی توانند در اتصال هیدروژنی با یکدیگر قرار بگیرند ، نقاط جوش بسیار کمتری نسبت به الکلها با وزن مولکولی مشابه دارند. به عنوان مثال ، نقطه جوش دی اتیل اتر (C4H10O)، وزن مولکولی [MW] 74) 35)درجه سانتیگراد (95 درجه فارنهایت) است ، اما نقطه جوش 1 بوتانول (یا الکل بوتیل الکل ؛ C4H10O ، MW 74) )است. 118 درجه سانتیگراد (244 درجه فارنهایت). در حقیقت ، نقاط جوش اترها به همان میزان آلکانها با وزنهای مولکولی مشابه نزدیکتر هستند. نقطه جوش پنتان (C5H12 ، 36 درجه سانتیگراد (97 درجه فارنهایت) ، نزدیک به نقطه جوش دی اتیل اتر است.
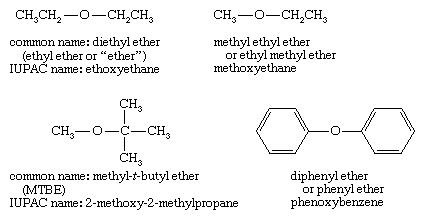
روش نامگذاری اترها
اسامی سطح پایین اترها به سادگی نام دو گروه آلکیل متصل به اکسیژن را می دهند و کلمه اتر را اضافه می کنند. روش فعلی لیست گروه های آلکیل به ترتیب حروف الفبا (T-butyl methyl) است ، اما نام های قدیمی اغلب گروه های آلکیل را با توجه به ترتیب اندازه (متیل تی بوتیل اتر) لیست می کنند. اگر فقط یک گروه آلکیل به اسم توصیف شده باشد ، این ترکیب شامل دو گروه یکسان است ، مانند اتیل اتر برای دی اتیل اتر
اسامی سیستماتیک IUPAC برای اترها از روش پیچیده تری به عنوان نام ریشه استفاده می کنند ، با اتم اکسیژن و گروه کوچکتر به عنوان یک جایگزین آلکوکسی. مثالهایی که در بالا ذکر شد عبارتند از: اتیوکسی اتان (دی اتیل اتر) ، متیوکسیاتان (متیل اتیل اتر) ، 2-متیوکسی-2-متیل پروپان (MTBE) و فنوکسی بنزن (دی فنیل اتر). نامگذاری IUPAC برای ترکیبات با گروههای کاربردی اضافی به خوبی کار می کند ، زیرا سایر گروههای را می توان با نام ریشه توصیف کرد.
انواع اترها از لحاظ ساختار
اترها بسته به گروه هیدروکربنی که به اکسیژن آن متصل است به اتر های نوع اول ، دوم و سوم تقسیم می شوند. یک اتر نوع اول: دیاتیل اترCH۳-CH۲-O-CH۲-CH۳. یکاتر نوع دوم:دیایزوپروپیل اتر (CH۳)۲CH-O-CH(CH۳)۲ و یک اتر نوع سوم: دیترسیوبوتیل اتر (CH۳)۳C-O-C(CH۳)۳.
روش های تولید اتر
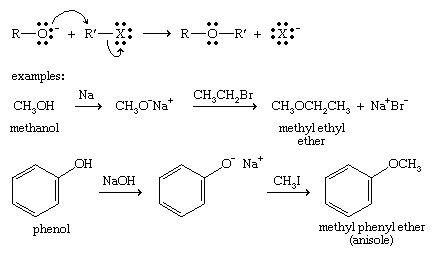
سنتز ویلیامسون :
کارآمد ترین روش برای ساخت اترها ، سنتز اتر ویلیامسون است ، که نام آن ببه افتخار شیمیدان انگلیسی الکساندر ویلیامسون است ، که این روش را در قرن نوزدهم ابداع کرد. از یک آلکاکسید برای حمله به آلکیل هالید استفاده می کند و گروه آلکوکسیOO-R را برای هالید جایگزین می کند. آلکیل هالید باید بدون مانع باشد ، یا حذف با تعویض مورد نظر رقابت می کند.
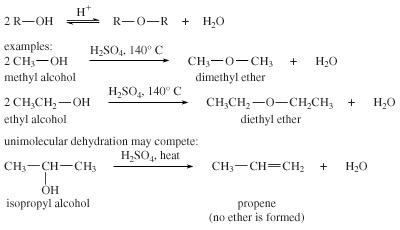
آبزدایی از مولکول
در محیط اسیدی ، دو مولکول یک الکل ممکن است فرآیند آبزدایی برای تشکیل اتر از دست رخ بدهد. آبزدایی تنها با گروه های آلکیل اولیه و ساده مانند گروه های دی متیل اتر و دی اتیل اتر بازده مفیدی از اتر تولید می کند. از آبزدایی برای تولید دی اتیل اتر بصورت تجاری استفاده می شود.
واکنش های اتر
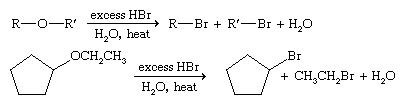
شکاف :
اترها تا حدودی حلالهای خوبی هستند زیرا واکنش چندانی ندارند. با این حال ، بیشتر اترها را می توان با اسید هیدروبرومیک برای دادن آلکیل برمیدها یا اسید هیدروودیک برای دادن آلکیل یدیدها استفاده کرد
اکسیداسیون :
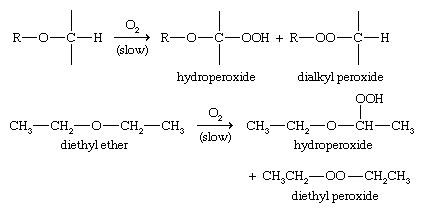
در حضور اکسیژن ، اترها به آرامی و به صورت خود به خودی اکسید می شوند تا هیدروپراکسیدها و دی اکسیل پراکسیدها تشکیل شوند. در صورت گرم شدن ، ممکن است این پراکسیدها منفجر شوند. برای جلوگیری از وقوع چنین انفجارها ، اترها را باید در مقادیر کمی تهیه کنید ، در ظروف محکم نگه دارید و به موقع استفاده کنید.
کاربردهای اتر
دی اتیل اتر
دی اتیل اتر یکی از شناخته شده ترین اترها است. اغلب به سادگی به عنوان “اتر” گفته می شود. فرمول دی اتیل اتر (C2H5) 2O) است. در ابتدا از دی اتیل اتر به عنوان بیهوشی استفاده می شد. در حال حاضر انواع مختلفی از کاربرد کوکائین گرفته تا مایع موتور دیزل دارد.
مشخصات دی اتیل تر
دی اتیل اتر با بوی خاص آن ، که گفته می شود شیرین است ، مشخص می شود. بسیار قابل اشتعال است و برای احتراق فقط به مقدار کمی انرژی فعال سازی نیاز دارد. در دمای اتاق ، حتی یک رادیاتور داغ یا صفحه داغ می تواند انرژی لازم برای احتراق دی اتیل اتر را تأمین کند. به طور خودجوش در تنها در دمای 170 درجه سانتیگراد شعله ور می شود ، بدون احتراق و شعله آتش می گیرد. مانند تمام اترها ، غیر قطبی یا فقط کمی قطبی محسوب می شود و از نقطه جوش نسبتاً کم 34.6 درجه سانتیگراد برخوردار است.
دی اتیل اتر و کوکائین
در بسیاری از آزمایشگاه ها از دی اتیل اتر به عنوان حلال استفاده می شود. از آنجا که دی اتیل اتر غیر قطبی است ، سایر مواد غیر قطبی را حل می کند و با مواد قطبی مانند آب قابل ردیابی نیست. بنابراین ، دی اتیل اتر یک حلال عالی برای چربی ها ، مومها ، روغنها ، عطرها ، آلکالوئیدها و لثه ها است. این باعث می شود دی اتیل اتر برای تولید غیرقانونی کوکائین خالص ، یک داروی قدرتمند و بسیار اعتیاد آور مورد استفاده قرارا گیرد.
کوکائین ، که یک ترکیب آلی غیر قطبی است ، به راحتی در دی اتیل اتر حل می شود. با این حال ، ناخالصی های موجود در کوکائین در دی اتیل اتر حل نمی شوند. حل کردن کوکائین در دی اتیل اتر باعث می شود تا تصفیه این ناخالصی ها آسان شود و محلول کوکائین خالص و دی اتیل اتر را پشت سر می گذارد. پس از آن ، محلول فرآوری می شود تا به شکل نمک هیدروکلراید کوکائین تبدیل شود که مورد استفاده قرار می گیرد.
تأثیر کوکائین در بدن
این داروی خطرناک می تواند باعث حمله قلبی ، سکته مغزی ، پارانویا و مرگ شود. این کار با جلوگیری از دوپامین ، انتقال دهنده عصبی که مسئولیت احساس لذت است ، از “بازیافت” توسط سلول که در ابتدا آن را آزاد می کند ، کار می کند. این امر باعث ایجاد دوپامین می شود و سرخوشی ایجاد می شود که با مصرف کوکائین همراه است.
دی متیل اتر به عنوان سوخت
دی متیل اتر یکی دیگر از اترهای شناخته شده است. فرمول شیمیایی آن CH3OCH3 است و ساده ترین اتر است. دی متیل اتر یک هیدروکربن است که دو گروه متیل به یک اکسیژن پیوند دارند. این ترکیب دارای نقطه جوش بسیار کم 23.6 درجه سانتی گراد است. دی متیل اتر فرمول تجربی مشابه اتانول C2H6O را به اشتراک می گذارد ، اما به دلیل اینکه ساختارهای مختلفی دارند ، این ایزومرها دارای خواص بسیار متفاوتی هستند. دی متیل اتر را می توان با استفاده از خوراکهای تجاری یا هیدروکربنهای فسیلی تشکیل داد. مطالعات نشان داده اند که ایجاد دی متیل اتر از محصولات فرعی صنعت مانند خمیر کاغذ نیز امکان پذیر است.
دی متیل اتر گاز بی رنگ است که کاربردهای مختلفی دارد. در حال حاضر آن را به عنوان پیشران آئروسل ، حلال آلی و ماده استخراج استفاده می کنند. همچنین به عنوان سوخت حمل و نقل مورد آزمایش قرار می گیرد زیرا نسبتاً غیر سمی است و نسبت به دیزل از تعداد بیشتری از سیتان استفاده می کند. تعداد بالاتر سیتان به این معنی است که دی متیل اتر تمیزتر و کامل تر از سوخت دیزل خواهد بود و باعث بهینه سازی راندمان انرژی برای خودرو می شود. تعداد سیتان دی متیل اتر 55-56 است ، در مقایسه با دیزل فسیلی 42-48 و بیودیزل 52-55. یکی دیگر از مزایای دی متیل اتر به عنوان منبع سوخت این است که برخلاف دیزل ، ترکیبات گوگرد دار و معطر را آزاد نمی کند. این انتشارات برای تنفس و محیط زیست مضر است.
واکنش احتراق دی متیل اتر است:
انرژی C2H6O + 3O2 → 2CO2 + 3H2O + انرژی
در زندگی واقعی ، این واکنش غیرممکن خواهد بود زیرا احتراق کامل فقط نظری است. شرایط ایده آل که تمام ملاک های احتراق برای تکمیل سوختن ضروری است ، وجود ندارد. همواره مقدار سوخت اضافی باقی مانده است. این می تواند به دلیل خطای انسانی ، اختلاط ناکافی در محفظه احتراق ، نبود اکسیژن یا پیوند هیدروژن باشد. با این حال ، احتراق دی متیل اتر هنوز هم بسیار کارآمد است.
انیسول و طبیعت
انیسولها ، که به عنوان متیوکسی بنزنها نیز شناخته می شوند ، اترهایی با فرمول شیمیایی CH3OC6H5 هستند. این ماده یک مایع نسبتاً غیر سمی است که دمای جوش شگفت آور آن 155 درجه سانتیگراد یا 313 درجه فارنهایت است. انیسول ها بوی تند و شیرینی دارند که یادآور گیاه گلدار ، انیسون هستند. این باعث می شود آن را برای استفاده در عطر و لوازم آرایشی مناسب کند. همچنین گاهی اوقات در داروهای دارویی نیز استفاده می شود. در طبیعت ، انیسول ها در بدن حشرات یافت می شود. سوسک های مادیرا ، سوسک های درخت بلوط اروپایی و ملخ های بیابانی از انیسول ها در سیستم های ارتباطی شیمیایی استفاده می کنند.
پلی اتیلن گلیکول و کاربردهای بسیاری از آن
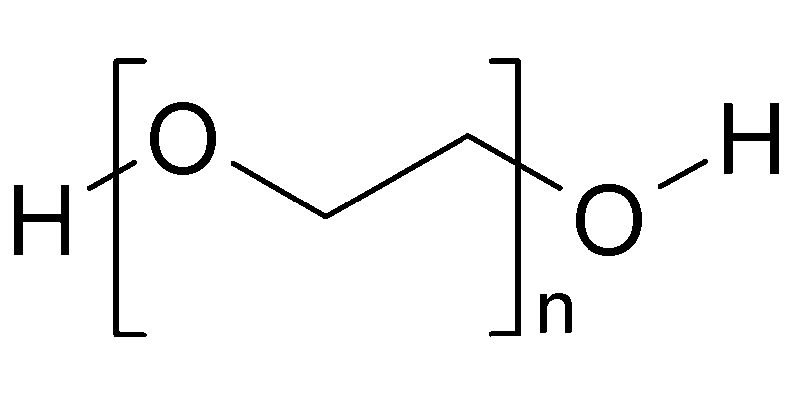
پلی اتیلن گلیکول (به طور خلاصه یک ترکیب آلی با زنجیره بلند و با ساختار شیمیایی C2n + 2H4n + 6On + 2 است. این می تواند در طول های مختلفی وجود داشته باشد از این رو متغیر n در فرمول مولکولی گنجانده شده است.
بسته به اندازه زنجیره آن ، PEG می تواند به صورت یک مایع روشن ، مومی یا جامد مات باشد. زنجیره های کوچک PEG با وزن مولکولی کمتر از 200 تمایل دارند که به عنوان شفاف درآیند. در وزن مولکولی 200-2000 ، زنجیره PEG یک ماده مومی است. هر زنجیره ای با وزن مولکولی سنگین تر از 2000 به عنوان جامد مات ظاهر می شود. برخلاف اکثر اترها ، PEG هم در ترکیبات آلی و هم در آب محلول است. از آنجا که پیوند اکسیژن-کربن در گروه اتر قطبی است ، گروههای مختلف اتی بر روی PEG قطبیت مولکول کلی را افزایش داده و آن را در سایر ترکیبات قطبی محلول می سازند. PEG ، غیر سمی و محلول در آب است ، اغلب در داروها و مواد افزودنی غذایی استفاده می شود.
کاربردهای PEG
کاربردهای PEG با اندازه زنجیره PEG تغییر می کند. از زنجیره های PEG با مولکول کم می توان به عنوان کرم های پوستی ، روان کننده ها ، پراکنده کننده در خمیردندان ها ، مواد ضخیم کننده و مواد اتصال دهنده در قرص ها و قالب ها استفاده کرد. زنجیره های PEG با مولکول بزرگتر به عنوان مواد بسته بندی مواد غذایی ، مواد اتصال دهنده و ضخیم کننده تر برای رنگ ها و در مراحل برای کروماتوگرافی گازی استفاده می شوند.
PEG ها به طور گسترده ای در خمیر دندان مورد استفاده قرار می گیرند.
بسیاری از این عملکردها به توانایی PEG در اتصال با آب و حلالهای آلی بستگی دارد. به عنوان مثال ، در خمیر دندان ، PEG آب را به آدامس زانتان متصل می کند ، بنابراین یکنواختی ترکیب را در سراسر خمیر دندان نگه می دارد. PEG محلول در آّب خم نیز نقش مهمی در کاربردهای آن دارد. از این ماده به عنوان ماده رهاسازی قالب و روان کننده برای ایجاد لاستیک های طبیعی و مصنوعی استفاده می شود. به دلیل حلالیت آنها در آب ، PEG ها را می توان به راحتی در این فرایندها استفاده کرد.
نویسنده : مهندس سید محسن حداد
منابع اصلی مقاله : ether
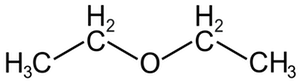






4 دیدگاه دربارهٔ «اترها-(ethers);
سلام
در یک پایان نامه بوی دی اتیل اتر رو زننده و سوزآور توصیف کردن. اما اینجا بوی شیرین. خیلی برام جالب شد 🙂 برای توصیف دی اتیل اتر تو مقاله م نیاز داشتم… که با قول های متفاوتی مواجه شدم.
سلام بهترین راهکار اینه که امتحان کنید
بویی نزدیک کلفرفورم هم داره .
سلام
کسی که اتر بیهوشی استفاده کنه تا چند ساعت ماده در خونش میمونه؟
اینکه گفته میشه اتر برای بیهوشی استفاده میشه برا قبلا بود،به دلیل اینکه احتمال بیدار شدن فرد در بیهوشی کم هست،یعنی فردی که بیهوش میشه شاید دیگه بلند نشه،دیگه برای بیهوشی استفاده نمیشه،ک بوی خیلی بدی داره